лимфоцитарная пневмония что это такое
Интерстициальная пневмония
Интерстициальная пневмония объединяет группу патологий, сопровождающихся течением воспалительного процесса в соединительной ткани паренхимы легких и в стенках альвеол с последующим развитием фиброза. Отсутствие терапии из-за несвоевременного выявления этой проблемы становится причиной инвалидности. Поставить правильный диагноз может только опытный специалист на основании результатов точной аппаратной диагностики.
Что такое интерстициальная пневмония
Интерстициальная (идиопатическая интерстициальная) пневмония – это хроническое или первичное острое воспаление межуточной легочной ткани, приводящее к фибропролиферативным изменениям и снижению дыхательных функций. Среди многочисленных пульмонологических заболеваний интерстициальная пневмония занимает особое место из-за продолжительного и тяжелого течения, а также частых неблагоприятных исходах, обусловленных прогрессирующими склеротическими и фиброзными изменениями в легких. Почти в каждом случае интерстициальная пневмония приводит к снижению качества жизни с последующей инвалидизацией.
Выделяют 8 подтипов интерстициальной пневмонии, разделенных на 4 группы:
— неспецифическая интерстициальная пневмония;
— идиопатический лёгочный фиброз;
- — десквамативная интерстициальная пневмония;
- — респираторный бронхиолит;
Чаще всего фиксируются следующие виды заболевания:
Причины возникновения
На данный момент этиология интерстициальной пневмонии еще не изучена. По мнению специалистов, развитие патологии провоцирует проникновение в легкие различных инфекций: вирусов, бактерий. Максимальную подверженность этому заболеванию обуславливают:
Также развитие пневмонии провоцируют некоторые виды пыли.
Симптомы и признаки
Патология сопровождается следующими симптомами:
У большей части пациентов в начале заболевания отмечается гриппоподобный синдром.
Методы диагностики
Постановка точного диагноза невозможна без тщательного обследования, включающего такие процедуры, как:
С этой целью лучше всего записаться в современный диагностический центр, располагающий новейшим оборудованием (МРТ, УЗИ, КТ легких) и штатом опытных специалистов. После исследования пациент может сразу же попасть на прием к эксперту в области лечения данного заболевания, который разработает эффективные методы.
Какой врач лечит
Лечением интерстициальной пневмонии занимается врач-пульмонолог. Также пациент может быть направлен к кардиологу, так как одновременно с легкими страдает и сердце.
Методы лечения
Для лечения интерстициальной пневмонии применяют два вида терапии: медикаментозную и немедикаментозную. В первом случае больному назначают глюкокортикоиды и цитостатические препараты, во втором – вентиляцию легких или кислородотерапию.
Результаты
Своевременная постановка диагноза и эффективный комплекс лечения позволяют значительно улучшить состояние пациента и даже добиться полного выздоровления. В запущенных формах избежать летального исхода поможет только пересадка легких.
Реабилитация и восстановление образа жизни
Реабилитация предполагает следующее:
Образ жизни при интерстициальной пневмонии
Во избежание обострений заболевания, пациентам показаны:
Своевременное лечение и грамотная реабилитация позволяет предотвратить развитие осложнений, и ускорят наступление полного выздоровления.
Интерстициальная пневмония с аутоиммунными признаками (ИПАП): мультидисциплинарный диагноз в пульмонологии и ревматологии
Диагноз идиопатической интерстициальной пневмонии с аутоиммунными признаками (ИПАП) объединяет пациентов с идиопатической интерстициальной пневмонией и рядом клинических, серологических и/или морфологических проявлений, указывающих на наличие системного аутоиммунного процесса, который, однако, не соответствует современным критериям определенного системного заболевания соединительной ткани. Результаты клинических исследований указывают на значительную неоднородность больных данной группы. В обзоре литературы обсуждаются классификационные критерии ИПАП, а также дальнейшие перспективы их применения для улучшения диагностики и лечения пациентов с данной патологией.
Идиопатические интерстициальные пневмонии (ИИП) представляют собой группу диффузных воспалительных и/или фибротических заболеваний легких, объединенных на основании сходных клинических, рентгенологических и гистологических признаков. Диагноз ИИП требует исключения известных причин интерстициальной пневмонии, таких как воздействие экзогенных факторов, токсические эффекты лекарственных препаратов или системное заболевание соединительной ткани (СЗСТ) [1]. Последние представляют собой группу аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, идиопатические воспалительные миопатии, синдром Шегрена, системная склеродермия и смешанное заболевание соединительной ткани. Интерстициальная пневмония (ИП) может быть одним из проявлений СЗСТ, причем в части случаев ее развитие предшествует появлению других симптомов заболевания 2.
У пациентов с ИИП могут наблюдаться отдельные клинические симптомы или серологические маркеры, характерные для аутоиммунной патологии, но не позволяющие установить диагноз какого-либо СЗСТ в связи с отсутствием всех необходимых критериев 8. Ранее исследователи предлагали различные критерии и термины для описания вышеуказанной когорты пациентов 6, в связи с чем длительное время отсутствовала возможность проведения мас штабных исследований, посвященных диагностике и лечению данной патологии.
В 2015 году экспертами Европейского респираторного общества (ERS) и Американского торакального общества (ATS) был предложен термин «интерстициальная пневмонии с аутоиммунными признаками (ИПАП)» [10]. Этим термином обозначают ИИП, сопровождающуюся клиническими, серологическими и/или морфологическими признаками, которые указывают на наличие системного аутоиммунного процесса, но не соответствуют современным критериям конкретного СЗСТ. Следует отметить, что это понятие было введено группой пульмонологов и ревматологов, в первую очередь, для удобства диагностики и унификации критериев включения пациентов в клинические исследовании, однако оно не может служить основанием для выбора метода лечения.
Критерии ИПАП
Классификационные критерии ИПАП распределены на три группы, или домена – клинический, серологический и морфологический (табл. 1) [10]. Для установления диагноза ИПАП 2 необходимы наличие ИП по данным компьютерной томографии органов грудной клетки высокого разрешения (КТВР) и/или хирургической биопсии легкого и тщательное клиническое обследование для исключения известных причин ИП, в том числе СЗСТ. Кроме того, диагноз ИПАП предполагает наличие соответствующих классификационных критериев, относящихся по крайней мере к двум из указанных групп.
| 1. | Наличие интерстициальной пневмонии (по данным КТВР или хирургической биопсии легкого) + |
| 2. | Исключение альтернативных причин ИП + |
| 3. | Несоответствие критериям конкретного СЗСТ + |
| 4. | Наличие по крайней мере одного критерия из 2 или более групп: А) Клинической Б) Серологической В) Морфологической |
| А. | Клиническая группа: |
| 1) | Трещины на коже дистальных фаланг пальцев («рука механика») |
| 2) | Кожные язвы дистальных фаланг пальцев |
| 3) | Артриты или скованность в утренние часы ≥60 мин с поражением нескольких суставов |
| 4) | Телеангиэктазии на коже ладоней |
| 5) | Феномен Рейно |
| 6) | Беспричинный отек пальцев |
| 7) | Беспричинная стойкая сыпь на коже разгибательной поверхности пальцев (симптом Готтрона) |
| Б. | Серологическая группа: |
| 1. | Антинуклеарные антитела (АНА) в титре ⩾1:320 при наличии диффузного, гранулярного или гомогенного паттерна свечения или a) АНА при наличии нуклеолярного паттерна (в любом титре) или б) АНА при наличии центромерного паттерна (в любом титре) |
| 2. | Ревматоидный фактор в титре ⩾2N |
| 3. | Антитела к циклическому цитруллинированному пептиду (АЦЦП) |
| 4. | Антитела к двуспиральной ДНК (анти-дсДНК) |
| 5. | Анти-Ro (SS-A) |
| 6. | Анти-La (SS-B) |
| 7. | Антитела к рибонуклеопротеину |
| 8. | Анти-Smith |
| 9. | Антитела к топоизомеразе (Scl-70) |
| 10. | Антитела к тРНК-синтетазе (Jo-1, PL-7, PL-12 и другие, в том числе EJ, OJ, KS, Zo, tRS) |
| 11. | Анти-PM-Scl |
| 12. | Анти-MDA-5 |
| С. | Морфологическая группа: |
| 1. | Предполагаемый паттерн по данным КТВР: a) Неспецифическая интерстициальная пневмония (НСИП) б) Организующая пневмония (ОП) в) Перекрест НСИП и ОП г) Лимфоцитарная интерстициальная пневмония (ЛИП) |
| 2. | Гистологический паттерн по данным биопсии легкого: a) НСИП б) ОП в) Перекрест НСИП и ОП г) ЛИП д) Интерстициальные лимфоидные узелки с герминативными центрами |
| 3. | Внепаренхиматозные легочные и внелегочные проявления (в сочетании с интерстициальной пневмонией) a) Необъяснимый плевральный выпот или утолщение плевры б) Необъяснимый перикардиальный выпот или утолщение перикарда в) Необъяснимое заболевание дыхательных путей (по данным легочных функциональных тестов визуализационных методов или биопсии) г) Необъяснимая легочная васкулопатия |
В клиническую группу критериев включены симптомы, относительно специфичные для ряда СЗСТ, такие как феномен Рейно, телеангиэктазии кожи ладоней, язвы дистальных фаланг пальцев 11. Тем не менее, сами по себе они не позволяют установить диагноз СЗСТ. В то же время алопеция, фотодерматит, язвы слизистой оболочки полости рта, снижение массы тела, сухой синдром, изолированные миалгия и артралгия не были включены в перечень признаков ИПАП в связи с низкой специфичностью.
Морфологическая группа критериев ИПАП включает в себя такие рентгенологические паттерны ИП, как неспецифическая интерстициальная пневмония (НСИП), организующая пневмония (ОП), перекрест НСИП и ОП, лимфоцитарная пневмония (ЛИП). Данные варианты легочного поражения достаточно часто встречаются при ИП, ассоциированных с СЗСТ (СЗСТ-ИП) 16. Обычная интерстициальная пневмония (ОИП) (рис. 2) также может быть выявлены у пациентов с СЗСТ, хотя и встречается реже [17], поэтому она не является критерием исключения ИПАП. Тем не менее, в отличие от НСИП, ОП и ЛИП, картина ОИП не входит в перечень морфологических признаков ИПАП.
Результаты клинических исследований
С момента введения критериев ИПАП в 2015 г. были опубликованы результаты ряда клинических исследований, в основном ретроспективных, в которых изучались проявления, течение и исходы этого заболевания. Хотя основной целью разработки классификационных критериев ИПАП было выделение относительно однородной группы пациентов, тем не менее, в проведенных исследованиях выборки характеризовались значительной вариабельностью [18].
В одном из наиболее крупных исследований J. Oldham с соавт. описали группу из 144 пациентов с ИПАП: средний возраст больных составил 63 года, а приблизительно у половины из них основным рентгенологическим и/или гистологическим паттерном была ОИП [19]. У 14,6% пациентов имелись клинические и серологические критерии диагноза, у 8,3% – клинические и морфологические, у 26,4% – все три критерия. У пациентов с ИПАП и идиопатическим легочным фиброзом (ИЛФ) смертность оказалась сходной. Однако при дополнительном анализе результатов исследования было показано, что выживаемость больных ИПАП зависела от рентгенологического варианта поражения легких. При наличии картины ОИП прогноз был сходным с таковым больных с ИЛФ, тогда как у пациентов с другими рентгенологическими паттернами выживаемость была значительно выше и сопоставимой с таковой при ИП, ассоциирующейся с СЗСТ. По данным многофакторного анализа, независимыми неблагоприятными прогностическими факторами были возраст и снижение диффузионной способности легких для монооксида углерода.
В другом исследовании S. Chartrand и соавт. описали 56 пациентов с ИПАП в возрасте в среднем 54,6 года, большинство из которых были некурящими [20]. Наиболее частым паттерном ИП при КТВР и биопсии легкого была НСИП (51,8%), в то время как ОИП была выявлена всего у 9% пациентов. Более чем у половины пациентов имелись классификационные критерии, относящиеся ко всем трем группам, у 37,5% – серологические и морфологические, у 9% – клинические и морфологические, у 1,5% (1 пациент) – серологические и клинические критерии. Наиболее частым клиническими симптомами были феномен Рейно (39,3%), «рука механика» (28,6%) и симптом Готтрона (17,9%). Среди серологических критериев чаще всего встречались АНА в диагностическом титре (48,2%), анти-Ro/SS-A (42,9%), а также анти-тРНК-синтетазные антитела (АТСА) (35,7%). В исследуемой группе не отмечено ни одного летального исхода в течение периода наблюдения (284±141,3 недель).
К. Ahmad и соавт. наблюдали 57 больных с ИПАП, среди которых у 11,1% выявлены клинические и серологические классификационные критерии, у 7% – клинические и морфологические критерии, у 52,7% – серологические и морфологические критерии, у 29,2% – все три критерия [21]. Средний возраст пациентов с ИПАП составил 64,4±14 лет. Соотношение мужчин и женщин было приблизительно одинаковым. 34% пациентов курили. Наиболее частыми рентгенологическими паттернами были НСИП (42,1%) и ОИП (28%), тогда как основным внепаренхиматозным проявлением среди морфологических критериев оказалась легочная васкулопатия (17,5%). В течение периода наблюдения длительностью 16 месяцев умерли 7 пациентов. Много факторный анализ показал, что только курение было неблагоприятным прогностическим фактором. В то же время следует отметить, что в отличие от исследования J. Oldham и соавт., авторы не выявили различия выживаемости между группами пациентов с паттернами ОИП и НСИП.
В исследование Y. Ito и соавт. были включены 99 пациентов с ИПАП [22]. Один пациент с паттерном ОИП был исключен из анализа. Среди остальных 98 пациентов у 64,3% выявлен морфологический паттерн НСИП, у 20,4% – ОП, у 15,3% – перекрест НСИП и ОП. Пятилетняя выживаемость составила 71,1%, средняя продолжительность жизни после установления диагноза – 12,5 лет. Неблагоприятным прогностическим фактором было наличие паттерна НСИП, в то время как серологических предикторов прогноза выявлено не было. У 12 (12,2%) пациентов с ИПАП в динамике отмечено развитие СЗСТ (в большинстве случаев – ревматоидного артрита).
К. Yoshimura с соавт. выделили подгруппу пациентов с ИПАП среди больных с фибротическими вариантами хронической ИП (ОИП и фиброзным вариантом НСИП) [23]. Среди классификационных критериев ИПАП чаще других встречались морфологические (97% пациентов), реже – серологические (72%) и клинические (53%). У пациентов с ИПАП были отмечены более высокая выживаемость и более низкая обострений основного заболевания. При анализе подгрупп у пациентов с ИПАП, сочетавшейся с паттерном НСИП, выживаемость была выше, чем у больных с идиопатической НСИП. Также следует отметить, что в данном исследовании была выявлена тенденция к более высокой выживаемости пациентов с ИПАП, у которых определялся паттерн ОИП, по сравнению с таковой больных с ИЛФ.
H. Chung и соавт. изучали морфологические предикторы прогноза у пациентов с ИПАП [24]. У большинства из них (65,4%) при КТВР был выявлен паттерн типичной или возможной ОИП. По данным однофакторного анализа, достоверными рентгенологическими признаками, ассоциированными со снижением выживаемости, были ретикулярные изменения, зоны «сотового легкого», мозаичная вентиляция (при отсутствии эмфиземы), а также увеличение диаметра легочной артерии. В то же время наличие паттерна ОИП по данным КТВР, а также степень выраженности фиброзных изменений в легких не позволяли предсказать прогноз. По данным многофакторного анализа, независимыми достоверными предикторами неблагоприятного прогноза оказались только зоны «сотового легкого» и увеличение диаметра легочной артерии.
Таким образом, большинство данных, характеризующих группу пациентов с ИПАП, получены в ретроспективных одноцентровых исследованиях, что не позволяет экстраполироват их на всю популяцию таких больных. Этим также может частично объясняться выраженная неоднородность результатов вышеуказанных работ. В частности, в настоящее время остается до конца не выясненным прогностическое значение паттерна ОИП у пациентов с ИПАП: в ряде исследований прогноз в данной подгруппе пациентов не отличался от такового у пациентов ИЛФ, в то время как авторы других работ не выявили сходной закономерности. Кроме того, следует отметить, что в большинстве исследований не учитывалось влияние проводимой иммуносупрессивной терапии на прогноз пациентов с ИПАП. С одной стороны, это ограничивает прогностическое значение полученных результатов исследований, а, с другой стороны, не позволяет разработать рекомендации относительно рациональной фармакотерапии данной патологии.
Обсуждение
Действующие в настоящее время критерии ИПАП были предложены в 2015 г. группой экспертов в области пульмонологии и ревматологии с целью выделения отдельной когорты пациентов с ИИП и признаками системных аутоиммунных заболеваний, не соответствующих классификационным критериям конкретного СЗСТ. Преимущество предложенной классификации заключается в том, что она заменила множество введенных ранее и различающихся между собой определений ИПАП, а также стала основой для разработки критериев включения пациентов в клинические исследования, необходимые для изучения этой патологии.
С учетом новых данных, полученных в группах пациентов с ИПАП, ряд исследователей предлагают различные варианты пересмотра и доработки существующих критериев заболевания. В частности, G. Sambataro и соавт. [18] указывают на то, что наличие среди критериев ИПАП специфичных или даже патогномоничных признаков СЗСТ (симптом Готтрона [25], «рука механика», антитела к цитруллинированному пептиду, АТСА и ряд других аутоантител) не является рациональным. Это объясняется тем, что классификационные критерии ИПАП пересекаются с таковыми недифференцированного заболевания соединительной ткани 26 или с критериями, предложенными для ранней диагностики некоторых СЗСТ. Таким образом, в дебюте часть СЗСТ могут ложно классифицироваться как ИПАП. Примером могут служить критерии ранней диагностики системной склеродермии (very early diagnosis of systemic sclerosis, VEDOSS) [28], которые позволяют идентифицировать пациентов с высоким риском развития этого заболевания. Данная группа пациентов представляет большой интерес, особенно учитывая тот факт, что наличие явных «склеродермических» признаков позволяет не только установить диагноз, но и начать лечение на ранней стадии заболевания.
Кроме того, критериям ИПАП может соответствовать часть пациентов с антисинтетазным синдромом. Принимая во внимание отсутствие единых международных критериев этого синдрома, пациентам с ИП и антисинтетазными антителми (АТСА) может был установлен диагноз как антисинтетазного синдрома, так и ИПАП, несмотря на высокий риск развития у них остальных клинических проявлений классической триады симптомов (артрит и/или миозит) [29]. В отношении антисинтетазного синдрома существует еще одна проблема: с одной стороны, у всех пациентов с ИП необходимо определять антитела, ассоциированные с воспалительными миопатиями, однако на практике в большинстве клинических лабораторий полный перечень данных аутоантител рутинно не исследуется, поэтому антисинтетазный синдром может остаться недиагностированным.
Рядом исследователей были предложены дополнения к существующему определению ИПАП, в частности в серологическую группу критериев рекомендовано включение дополнительных антител, таких как АНЦА [30] и анти-Ku антитела [31]. Уже описаны когорты пациентов с АНЦА-позитивной ИП. Тем не менее, на настоящий момент количество данных относительно этой группы больных весьма ограничено. H. Yamada описал группу из 92 пациентов с ИП, которую ранее классифицировали как ИЛФ с наличием АНЦА [32]. В данной когорте у 35,8% отмечалось наличие АНЦАассоциированного васкулита в дебюте заболевания, еще у 17,4% пациентов он развился в течение нескольких лет после установления диагноза, а у оставшихся 46,8% пациентов ИП оставалась единственным клиническим проявлением заболевания. У части пациентов при биопсии легкого определялись признаки васкулита с поражением интерстиция и/или бронхов. Авторами статьи предложено два возможных механизма формирования интерстициальных изменений в легких при наличии АНЦА. Первый предполагает развитие интерстициального фиброза в результате субклинических альвеолярных геморрагий. В соответствии со второй гипотезой в ответ на образование воспалительных цитокинов миелопероксидаза экспрессируется на поверхности нейтрофилов, что может приводить к фиксации циркулирующих АНЦА с последующей дегрануляцией нейтрофилов и высвобождением активных форм кислорода, которые вызывают повреждение легочной ткани и развитию фиброза. Второй механизм, в частности, способен объяснить развитие АНЦА-ассоциированной ИП без признаков системного васкулита.
Таким образом, текущие диагностические критерии ИПАП охватывают весьма неоднородную группу пациентов, в связи с чем в большинстве исследований проводился поиск прогностических факторов выживаемости пациентов с ИПАП. Особый интерес вызывает морфологический паттерн ОИП, относительно значения которого в настоящее время нет единого мнения. Отсутствие ОИП в группе морфологических критериев ИПАП, с одной стороны, и более низкая выживаемость в данной подгруппе пациентов по результатам ряда исследований, с другой стороны, ставят вопрос о том, не должны ли пациенты с ОИП исключаться из клас сификационной группы ИПАП. Тем не менее, до появления данных проспективных исследований, подтверждающих внутригрупповую неоднородность ИПАП, выявления достоверных предикторов прогноза выживаемости и ответа на различные варианты терапии, пациентов с ОИП следует включать в группу ИПАП при наличии клинических и/или серологических критериев данного диагноза [33].
В ближайшем будущем необходимо проведение проспективных клинических исследований с целью изучения эффективности иммуносупрессивных, и возможно, антифибротических препаратов у пациентов с ИПАП. При большинстве вариантов СЗСТ-ИП и не-ОИП вариантах идиопатической ИП основной медикаментозной терапии являются глюкокортикостероиды, которые в части случаев сочетают с иммунодепрессивными и генно-инженерными биологическими препаратами, однако они неэффективны при ИЛФ, который представляет собой вариант идиопатической ИП с рентгенологическим паттерном ОИП [34,35]. Учитывая доказанную эффективность антифибротической терапии у пациентов с ИЛФ, не исключена возможность ее применения у части пациентов с ИПАП.
Заключение
Диагноз ИПАП был введен с целью унификации группы пациентов с ИП, у которых определяются отдельные симптомы системных аутоиммунных заболеваний. Тем не менее, данные клинических исследований указывают на то, что текущее определение ИПАП, вероятно, не позволяет выделить однородную популяцию больных. Уточнение классификационных критериев ИПАП может оказаться полезным для выделения отдельных вариантов этого состояния, отличающихся по клиническому течению, ответу на терапию и прогнозу, в том числе вероятности развития определенных системных заболеваний соединительной ткани. Для подтверждения данной гипотезы требуется проведение многоцентровых проспективных исследований с междисциплинарным подходом к диагностике и выбору терапии пациентов с ИПАП.
Идиопатические интерстициальные пневмонии: клиника, диагностика, лечение
Достижения молекулярной биологии и внедрение в медицину новых методов обследования, в значительной степени коснувшееся респираторной медицины, во многом изменили представления о сути болезней, связанных с поражением легочного интерстиция. На современном
Достижения молекулярной биологии и внедрение в медицину новых методов обследования, в значительной степени коснувшееся респираторной медицины, во многом изменили представления о сути болезней, связанных с поражением легочного интерстиция. На современном этапе в группу интерстициальных болезней легких объединены более 200 острых и хронических заболеваний, характеризующихся повреждением, воспалительными и фибропролиферативными реакциями, затрагивающими аэрогематический барьер. Эти заболевания представляют большие трудности для диагностики, так как нередко их трудно отличить на основании рентгенологических проявлений от болезней легких бактериальной природы, и в особенности от пневмоний или туберкулеза. Ошибочное назначение антибиотиков может становиться причиной побочных реакций, являющихся, по сути, ятрогенными, и тем самым ухудшает прогноз.
Особое внимание специалистов, занимающихся проблемами пульмонологии, привлекают те формы интерстициальных болезней легких, этиология которых остается неустановленной. К ним относятся идиопатические интерстициальные пневмонии (ИИП), отличающиеся тяжестью течения и неблагоприятным прогнозом вследствие необратимо прогрессирующих процессов фиброзной перестройки легкого. Значительные успехи отечественной и зарубежной пульмонологии не привели к снижению частоты заболевших ИИП, при большинстве из которых пациент на поздней стадии болезни нуждается в постоянной респираторной поддержке вследствие необратимой потери легочных функций. Напротив, согласно данным исследований, проводившихся в Европе, Англии и США, за период с 1995 по 2003 г. показатели заболеваемости ИИП многократно выросли: в среднем, в зависимости от страны, от 7 до 50 случаев на 100 000 человек. Так как у большинства больных ИИП приводят к снижению качества жизни и инвалидизации, а стационарно-диспансерное ведение пациентов обязательно предусматривает использование дорогостоящих лечебно-диагностических мероприятий, то прямые и непрямые медицинские расходы, обусловленные преждевременной смертностью от ИИП, уже сегодня могут представлять значительный экономический и социальный ущерб.
Существующий разрыв между интенсивно обогащающимися знаниями о механизмах развития ИИП и неудачами в их диагностике и лечении определяется отсутствием единого представления о нозологической принадлежности заболеваний. Хотя к группе ИИП отнесены семь типов морфологических изменений, нозологическую принадлежность получила только обычная интерстициальная пневмония. Это заболевание именуется идиопатическим легочным фиброзом (ИЛФ) и отличается от других тяжелым течением и очаговой фибропролиферацией в легких с быстрым прогрессированием пневмосклероза в виде формирования на поздней стадии «сотового легкого». Замечено, что идиопатический легочный фиброз чаще развивается у мужчин пожилого возраста, тогда как остальные формы ИИП диагностируются в основном у женщин. Кроме того, среди больных ИИП нередко встречаются курящие или курившие ранее лица. Однако необходимо признать, что особенности клиники ИИП по-прежнему недостаточно хорошо изучены и выделение их производится главным образом на основе «патогенетического своеобразия форм» (И. В. Давыдовский).
Таким образом, на сегодняшний день к группе ИИП можно отнести:
Какие бы мнения ни существовали относительно классификации ИИП, данный вопрос не столь уж важен с практической точки зрения, поскольку эти тяжелые, характеризующиеся неблагоприятным прогнозом болезни, мало изучены. Диагностические и терапевтические подходы к ведению таких больных до сих пор во многом неясны. Большинство работ, посвященных проблеме идиопатического фиброзирующего альвеолита, являются преимущественно морфологическими и основаны лишь на небольшом клиническом материале.
Наиболее действенным подходом к диагностике ИИП становится клиническая интерпретация фактов, полученных в результате обследования больного, начиная с тщательного сбора анамнеза, выявления возможных факторов риска поражения легких, физического обследования и вплоть до применения таких высокотехнологичных современных методов исследования, как компьютерная томография легких высокого разрешения (КТВР) и биопсия легкого.
Клинически ИИП, как и другие формы интерстициальных заболеваний, характеризуется малопродуктивным кашлем, прогрессирующей одышкой, которую большинство больных описывают как чувство «неполного вдоха» и даже рукой могут указывать на область «преграды» — на уровне диафрагмы. Нередко пациенты просыпаются ночью от внезапного чувства нехватки воздуха или ощущения «плиты на груди». Последние симптомы, по-видимому, обусловлены срывом адаптации хеморецепторов респираторного центра к нарастающей гипоксии в условиях нарушения диффузионной способности легких и появлением эпизодов апноэ. Именно одышка, ограничивающая повседневную активность больных и снижающая качество жизни при ИИП, становится главной причиной обращения к врачу. При осмотре у таких больных отмечаются цианоз, постепенно распространяющийся на кожных покровах по мере усугубления гипоксии и гипоксемии, изменение концевых фаланг пальцев и ногтей в виде «барабанных палочек» и «часовых стекол» («пальцы Гиппократа»).
Потеря респираторных функций, наблюдаемая у большинства пациентов с ИИП, сопровождается появлением типичного аускультативного феномена — нежной крепитации. Именно крепитацию можно расценивать как наиболее достоверный клинический ориентир, указывающий на вовлечение легочного интерстиция. При ИИП крепитация имеет свои особенности: на ранней стадии выслушивается симметрично преимущественно над базальными отделами легких и по мере прогрессирования болезни распространяется постепенно на все легочные поля вплоть до верхушек легких. Грубая крепитация, выслушиваемая над ограниченными участками легких, исчезающая при глубоком дыхании и особенно сопровождающаяся хрипами, в большей степени относится к дыхательным шумам, возникающим в старческом легком, при пневмосклерозе в исходе хронической обструктивной болезни легких либо при инфекционных поражениях легких, в том числе и банальной пневмонии.
В лабораторных показателях у больных ИИП, в особенности когда речь идет о варианте, морфологически представленном обычной интерстициальной пневмонией — ИЛФ, нередко отсутствуют выраженные сдвиги показателей иммунитета. Хотя и обнаруживается некоторое повышение уровня иммуноглобулинов, циркулирующих иммунных комплексов, СОЭ нередко сохраняется на уровне, близком к норме, что можно объяснить полицитемией у больных на стадии «сотового легкого» в условиях формирования легочного сердца. При этом низкая активность таких маркеров иммунного воспаления, как γ-глобулины, IgG, при ИЛФ позволяет предполагать патогенетические особенности последнего, заключающиеся в преобладании процессов фиброзирования над воспалением. Полученные данные согласуются с современными представлениями об обычной интерстициальной пневмонии как о заболевании с генетически детерминированным нарушением экспрессии профиброгенных факторов, определяющих изначально высокую активность субпопуляций клеток с профиброгенным фенотипом, интенсивно синтезирующих факторы роста, что приводит к быстрому накоплению экстрацеллюлярного матрикса на стадии «сотового легкого». При других формах ИИП, например десквамативной интерстициальной пневмонии, наоборот, гуморальные сдвиги имеют циклический характер, обнаруживаются при обострении заболевания и сопровождаются повышением активности интерстициального воспаления — альвеолита.
При ИИП в целом наблюдается значительное снижение показателей жизненной емкости легких (ЖЕЛ), фиксированной жизненной емкости легких (ФЖЕЛ) и диффузионной способности легких (DLCO), тогда как объем форсированного выдоха за 1 с (ОФВ1) и индекс Тиффно могут и не меняться. Такое распределение параметров функции внешнего дыхания (ФВД) соответствует нарушениям преимущественно рестриктивного типа. При обычной интерстициальной пневмонии (ИЛФ) тяжесть дыхательных расстройств отличается от других форм ИИП резким и крайне резким снижением ЖЕЛ, ФЖЕЛ. Причем степень снижения показателей ФВД и диффузионной способности легких, как подтверждают наши работы и наблюдения других авторов, не зависят от длительности болезни. Тяжелая дыхательная недостаточность с признаками легочного сердца может развиться за период от 2 мес до 2 лет. При десквамативной ИИП наблюдается более благоприятное хроническое течение — до 10–13 лет.
Высокой прогностической ценностью обладает ФЖЕЛ, снижение которой более чем на 67% от нормы было связано с более низкими показателями выживаемости. Быстрое снижение показателей ФВД в течение 6-месячного периода коррелирует при различных вариантах ИИП с неблагоприятным прогнозом (r = 21,43; p = 0,03). DLCO также рассматривается как эквивалент адекватного функционирования аэрогематического барьера, с одной стороны, и как показатель морфологической активности альвеолита — с другой. Выраженное снижение DLCO — до 30% от нормы, даже при удовлетворительном уровне ЖЕЛ, а также динамическое снижение DLCO в течение года на 20% по сравнению с первоначальным уровнем сопровождается значительной потерей ФЖЕЛ и увеличением смертности больных.
Особо следует отметить значение бронхиальной обструкции, клинические признаки которой отмечаются практически у 30% больных ИИП. Чаще бронхиальная обструкция наблюдается при десквамативной интерстициальной пневмонии в период обострения заболевания, тогда как при обычной интерстициальной пневмонии она встречается значительно реже — только у 4 % пациентов.
 |
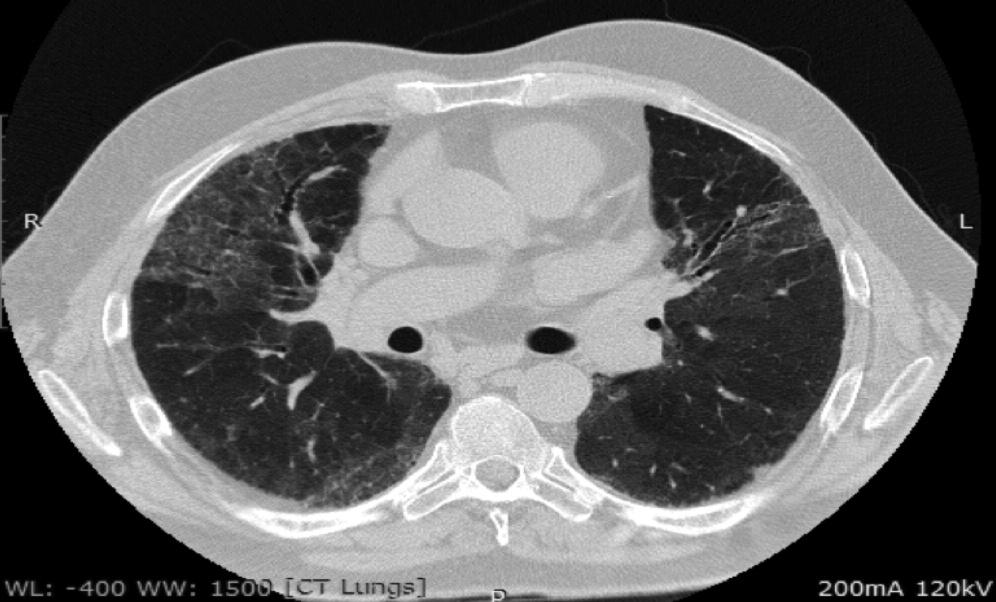
| Рисунок 1. Больной П., 54 года, диагноз — ИЛФ; для подтверждения диагноза проведена торакоскопическая биопсия легкого (результаты морфологического исследования — обычная интерстициальная пневмония). На КТ — участки кистозно-фиброзной трансформации («сотовое легкое») |
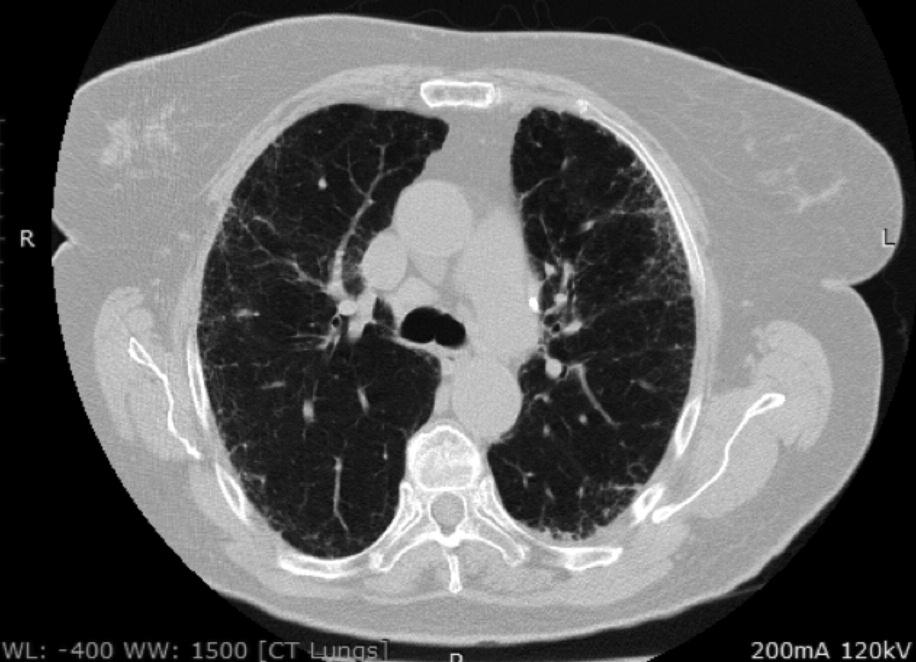
Наиболее информативным методом диагностики и мониторирования течения ИИП является компьютерная томография легких. Использование КТ-методов, в том числе с программами высокого разрешения, позволяет не только подтвердить, что изменения в легких обусловлены ИИП, но и ориентировочно предположить, что речь идет о морфологическом варианте заболевания. Типичным признаком для ИИП являются симптомы «матового стекла» и кистозно-фиброзные структуры («сотовые легкие») (рис. 1, 2).
При прогнозировании течения ИИП особое значение придают легочной гипертензии, присоединение которой повышает риск формирования легочного сердца и связанных с ним осложнений. Следует подчеркнуть, что поражение сердца и сосудов малого круга кровообращения при ИИП по клиническим и молекулярно-биологическим проявлениям во многом напоминает первичную легочную гипертензию. Вовлечение сердца при ИИП можно заподозрить уже при обычном физическом обследовании — акцент и расщепление II тона на легочной артерии, расширение сердечной тупости и смещение границ сердца вправо. Показано, что при ИИП КТВР-критерии, свидетельствующие о легочной гипертензии, опережают ЭхоКГ-признаки гемодинамических нарушений в малом круге кровообращения, так как последние появляются только при относительно высоких показателях площади кистозно-буллезной трансформации в легких (более 32,1 ± 5,1%). Установление компьютерно-томографических эквивалентов активности интерстициальной воспалительной реакции (альвеолита) и фиброза необходимо для определения стадии, прогноза и лечения идиопатического фиброзирующего альвеолита.
 |
| Рисунок 2. Больной М., 45 лет, идиопатическая интерстициальная пневмония (морфологический вариант — десквамативная интерстициальная пневмония). На КТ — «матовое стекло», фиброз |
Вне зависимости от варианта течения ИИП, развернутая картина болезни с тяжелой легочно-сердечной недостаточностью появляется только на стадии «сотового легкого». Учитывая известные представления о «сотовом легком» как о результате нарушений сложных процессов репарации ткани (wound-healing), влекущих за собой смену функциональной активности клеток с появлением клеточных субпопуляций, которые несут опухолевый генотип, развитие «сотового легкого» может расцениваться как стадия, неблагоприятная по прогнозу в первую очередь из-за риска возникновения рака легкого. Кроме того, «сотовое легкое» как рентгено-морфологический эквивалент необратимой потери респираторной функции легких, когда достижение удовлетворительной коррекции дыхательной недостаточности даже при использовании новейших методик респираторной поддержки остается практически невозможным, определяет отношение в поздней стадии ИИП как к неблагоприятному исходу, тем более что трансплантация легких остается для больных ИИП единственным кардинальным методом лечения, сложность исполнения которого не позволяет пока оправдать возложенные на него надежды.
Для определения степени риска неблагоприятного прогноза у больных идиопатическим фиброзирующим альвеолитом нами был проведен факторный анализ взаимосвязи клинических, функциональных, морфологических изменений, влияющих на развитие «сотового легкого» (табл. 2). В целом по группе обследованных больных пол и возраст значимого влияния на прогноз не оказывали. Наиболее высокой прогностической ценностью характеризовались рентгено-морфологические критерии активности ИИП. Основными, связанными с формированием «сотового легкого», были КТВР-показатели площади фиброза на ранней стадии болезни (χ 2 = 7,73; р 2 = 28,4; р = 0,00001).
У больных с обширными полями «матового стекла» риск неблагоприятного прогноза невысок. Достоверная взаимосвязь между риском формирования «сотового легкого» и индексом гистологической активности интерстициального воспаления отсутствует (χ 2 = 0,20; р = 0,88). Действительно, симптом «матового стекла» как эквивалент гистологической активности воспаления в легочном интерстиции наиболее часто выявляется при относительно благоприятных формах ИИП, например десквамативной интерстициальной пневмонии. При этом длительно сохраняющийся, несмотря на проводимое лечение, симптом «матового стекла» (даже при небольшой его площади) в сочетании с приростом площади интерстициального фиброза и — как выражение крайней его степени — кистозно-буллезной трансформацией достоверно связан с неблагоприятным прогнозом (χ 2 = 4,81; р = 0,049). Наиболее часто такая зависимость отмечается при обычной интерстициальной пневмонии. У больных с хорошим ответом на терапию, т. е. с уменьшением в результате лечения на КТВР площади «матового стекла» и отсутствием прироста площади фиброза, развернутая картина «сотового легкого» формируется существенно реже.
Успех диагностики и лечения ИИП зависит от правильной организации лечебно-диагностического процесса. Рекомендации ERS/ATS по ведению больных ИИП предусматривают тесное сотрудничество пульмонолога, рентгенолога, морфолога и торакального хирурга. Эффективность терапии определяется через 3 мес от начала лечения на основании стационарного обследования больного и сравнения результатов КТ, оценкой функциональной способности легких. Критерием эффективности терапии считается снижение площади «матового стекла» и отсутствие новых участков образования «сотовых структур». Обязательная программа обучения пациентов включает разъяснение причин заболевания, правил профилактики вредных воздействий (профессиональные факторы, воздействия внешней среды, пассивное курение).
Несмотря на существующие сегодня представления об ИИП как об изначально тяжелом заболевании с неблагоприятным прогнозом, клиницисты воздерживаются от назначения лечения, в особенности при малосимптомном течении болезни. По данным Британского торакального общества, в 64% случаев врачи не начинают лечение ИИП у больных со стертой клинической картиной, при стабильном течении ИИП, реже причинами отказа от назначения терапии являются угроза побочных эффектов, коморбидные состояния, пожилой возраст, а также развернутая стадия болезни («сотовое легкое»). С нашей точки зрения, такую позицию нельзя считать оправданной, хотя последствия иммуносупрессивного лечения действительно в ряде случаев по тяжести вызываемых им расстройств оказываются сопоставимы с нарушениями, связанными с основным заболеванием. Как показывает опыт, даже при медленно прогрессирующих формах ИИП в легких развиваются необратимые склеротические изменения, и на этой стадии запоздалая терапия уже малоэффективна.
ИИП относится к заболеваниям, при котором ни одно из известных лекарственных средств не позволяет предупредить снижение функции легких в долговременной перспективе. Во многом это определяется гетерогенностью морфологических изменений при ИИП. Вот почему, назначая терапию идиопатического фиброзирующего альвеолита, необходимо учитывать прежде всего патоморфологический вариант болезни. Известно, что при таких вариантах ИИП, как десквамативная интерстициальная пневмония, неспецифическая интерстициальная пневмония, наблюдается хороший или удовлетворительный ответ на кортикостероидную терапию. При этом кортикостероиды назначаются на длительные сроки, в том числе и в режиме высоких доз. В то же время при ИЛФ, представляющем собой заболевание с интенсивной фибропролиферацией, традиционно используемые иммуносупрессивные препараты, как удалось показать в ходе большинства проведенных сравнительных рандомизированных исследований, практически не влияют на выживаемость больных. Рекомендуемая первоначальная доза кортикостероидных препаратов у больных с различными вариантами ИИП колеблется от 0,5 до 1,0 мг/кг, максимальная — 60 мг для ежедневного перорального приема. Назначение кортикостероидов по альтернативным схемам (через день) не оправдано и по сравнению с другими программами лечения не имеет преимуществ по критериям выживаемости или терапевтической эффективности.
Опираясь на собственный опыт лечения больных ИИП, мы применяем методику сочетания высоких доз метилпреднизолона в течение 2 первых недель лечения (до 3 г в неделю, т. е. 800 или 1000 мг на одно введение) с умеренными или даже низкими пероральными дозами (не более 0,25 мг/кг). В дальнейшем такие «пульсовые» введения следует проводить в режиме 1000 мг в неделю в сочетании с прежней пероральной дозой.
У больных с идиопатическим фиброзирующим альвеолитом, получающих преднизолон, необходим контроль туберкулиновых проб для своевременного выявления возможных вторичных инфекций. Назначения фторхинолонов или триметоприма до 3 г в неделю достаточно для достижения необходимого туберкулостатического эффекта и профилактики Pneumocystis carinii. Прекращение приема кортикостероидов необходимо при выраженных побочных эффектах.
При прогрессировании фибропластических изменений в легких целесообразно ограничиться низкими дозами кортикостероидов и сделать выбор в пользу препаратов, препятствующих избыточному накоплению экстрацеллюлярного матрикса (колхицин, азатиоприн, метатрексат, циклофосфан, циклоспорин). Однако даже агрессивная цитостатическая терапия также не всегда позволяет замедлить темпы прогрессирования легочного фиброза. Следует учитывать и высокий риск нежелательных реакций, вызываемых иммуносупрессивными препаратами. Другой возможной мишенью для лечения ИИП является легочное сосудистое русло. Представление об ИИП как о заболевании, связанном с тяжелыми изменениями функциональной активности эндотелия, обосновывает применение препаратов, напрямую или опосредованно контролирующих вазоактивные факторы. Среди них особо следует указать ингибиторы эндотелина 1, антифиброгенные влияния которого убедительно доказаны экспериментальным путем. Недавно начатые многоцентровые, плацебо-контролируемые, рандомизированные исследования по применению ингибитора эндотелина-1 (бозентана) при ИЛФ (BUILD-1) и вторичном легочном фиброзе вследствие системной склеродермии (BUILD-2) уже на доклинических этапах показали нарастание легочных функций у больных в тестах с нагрузкой. Если принципы использования препаратов, регулирующих функциональную активность эндотелия при идиопатическом фиброзирующем альвеолите, находятся на стадии разработки, а результаты часто оказываются противоречивыми из-за кратковременного эффекта простаноидов, то внедрение в процессы повреждения эпителия, и в том числе взаимоотношений эпителий–фибробласт, рассматривается как реальный способ проведения длительной терапии, направленной на замедление темпов прогрессирования пневмосклероза.
Одно из направлений этой терапии — применение антиоксидантов в высоких дозах у больных ИИП — считается перспективным. Положительное влияние антиоксидантов, в частности α-токоферола, на функции легких убедительно доказано при различных формах интерстициальных болезней легких, и прежде всего при гранулематозах (саркоидозе). По нашим данным, курсовое введение больным с десквамативной интерстициальной пневмонией и облитерирующим бронхиолитом α-липоевой (тиоктовой) кислоты увеличивало показатели нагрузочных проб (6-минутный тест с ходьбой), а также способствовало поддержанию толерантности к глюкозе, позволяя тем самым достичь органосберегающих эффектов, что имеет особое значение для больных, длительно получающих кортикостероидную терапию.
Между тем современные подходы к лечению ИИП, каким бы успешным оно ни казалось, остаются патогенетическими. Причины развития ИИП по-прежнему до конца не раскрыты, поэтому поиск доказательств, указывающих на тот или иной «стимул», запускающий фибропролиферативные и воспалительные процессы в легких, следует считать наиболее важным направлением в построении лечебной стратегии заболевания.
Литература
Е. Н. Попова, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва