лимфоцитарно плазмоцитарная инфильтрация желудка что это такое
Лимфоцитарно плазмоцитарная инфильтрация желудка что это такое
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
Особенности В-лимфоцитарной инфильтрации прилежащей к опухоли слизистой оболочки желудка при раке. Клинико-морфологические аспекты
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(5): 8-11
Сеньчукова М. А., Рябов А. Б. Особенности В-лимфоцитарной инфильтрации прилежащей к опухоли слизистой оболочки желудка при раке. Клинико-морфологические аспекты. Онкология. Журнал им. П.А. Герцена. 2015;4(5):8-11.
Senchukova M A, Ryabov A B. Characteristics of B-lymphocytic infiltration in the peritumoral mucosa of the stomach in its cancer: Clinical and morphological aspects. P.A. Herzen Journal of Oncology. 2015;4(5):8-11.
https://doi.org/10.17116/onkolog2015458-11
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Цель исследования — изучение особенностей перитуморальной инфильтрации слизистой оболочки желудка (СОЖ) В-лимфоцитами и их связь с клиническими характеристиками рака желудка (РЖ). Материал и методы. Исследованы образцы ткани опухоли и прилежащей СОЖ у 73 радикально оперированных пациентов РЖ. Гистопрепараты окрашивали гематоксилином и эозином и иммуногистохимически, с использованием антител к CD20. Результаты. В перитуморальной области отмечено три вида структур с экспрессией CD20: В-лимфоциты, расположенные диффузно, лимфоидные фолликулы (ЛФ) и очаговые лимфоидные инфильтраты (ЛИ). Установлены отрицательные корреляции плотности СD20 В-лимфоцитов с распространенностью РЖ. Наиболее низкие значения плотности СD20 В-лимфоцитов наблюдались при низкодифференцированной аденокарциноме и недифференцированном РЖ (р=0,051), при глубине инвазии опухоли Т1—2 (р=0,06) и наличии метастазов в регионарных лимфатических узлах (р=0,02). Наличие ЛИ и ЛФ было связано только с гистологическим типом РЖ. При диффузном и кишечном типах РЖ очаговые ЛИ наблюдались в 46,7 и 21,4% случаев (р=0,15) и множественные ЛФ — в 72,7 и 38,9% случаев (р=0,07) соответственно. Наличие очаговых ЛИ было связано со статистически недостоверным снижением 3-летней общей выживаемости с 94,7 до 70,0% (р=0,07), а наличие множественных ЛФ — со снижением 3-летней безрецидивной выживаемости с 75 до 40% (р=0,08). Заключение. Полученные данные свидетельствуют о связи В-лимфоцитов с клиническими характеристиками и отдаленными результатами лечения РЖ. Полагаем, что необходимы дальнейшие исследования роли В-лимфоцитов в прогрессии РЖ.
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
Рак желудка (РЖ) остается одной из наиболее частых причин смерти от злокачественных опухолей во всем мире [1, 2]. Определение факторов, влияющих на прогноз РЖ, важно как для диагностики, так и для поиска новых схем лечения этого заболевания. Одним из таких факторов является выраженность воспалительных изменений в опухоли и прилежащих тканях. Однако оценка его роли в опухолевой прогрессии неоднозначна. Одни авторы считают, что высокая инфильтрация опухоли и прилежащих тканей иммунными клетками может быть связана с противоопухолевой активностью и с лучшей выживаемостью онкологических больных [3, 4]. Другие предполагают, что опухолеассоциированные лимфоциты и макрофаги могут быть связаны с опухолевой прогрессией [5—8]. При этом следует отметить, что большинство исследований связано с изучением роли Т-лимфоцитов и макрофагов в опухолевой прогрессии [3, 8, 9], тогда как роль В-лимфоцитов остается практически неизученной. В связи с этим целью настоящего исследования явилось изучение особенностей перитуморальной инфильтрации слизистой оболочки желудка (СОЖ) В-лимфоцитами и их связь с клиническими характеристиками РЖ.
Материал и методы
В проспективное исследование включены 73 пациента с РЖ, радикально оперированных (R0) в Оренбургском областном клиническом диспансере с января 2009 г. по июль 2010 г. Средний возраст пациентов составил 61,2±9,3 года (от 34 до 78 лет, медиана — 61 год). Мужчин было 43 (58,9%), женщин — 30 (41,1%). Опухоль локализовалась в верхней трети у 14 (19,2%) пациентов, в средней трети — у 18 (24,7%) и нижней трети — у 41 (56,1%). Кишечный тип рака желудка был отмечен у 41 (56,2%) больного и диффузный — у 32 (43,8%). Высокодифференцированная аденокарцинома (G1) наблюдалась у 27 (36,9%) пациентов, умереннодифференцированная (G2) — у 14 (19,3%), низкодифференцированная аденокарцинома и недифференцированный РЖ — у 9 (12,3%) и перстневидно-клеточный рак (ПКР) — у 23 (31,5%). Распределение больных по стадии заболевания было следующим: T1—2N0M0 — у 34 (46,6%), T3N0M0 — у 9 (12,3%), T3—4N1M0 — у 9 (12,3%) и T3—4N2M0 — у 21 (28,6%) больного.
Субтотальная проксимальная резекция была выполнена 10 (13,7%) пациентам, субтотальная дистальная резекция — 56 (76,7%) и гастрэктомия — 7 (9,5%). Лимфаденэктомия в объеме D2 была выполнена всем пациентам, с элементами D3 — 38 (52,0%). У 7 (12,3%) больных произведены комбинированные операции: в 3 наблюдениях была выполнена спленэктомия, в 2 — резекция поперечной ободочной кишки, в одном — холецистэктомия. В исследование не включали больных с декомпенсацией хронических заболеваний, острой инфекционной патологией, выраженными аллергическими процессами, а также получавшие кортикостероиды, антигистаминные, нестероидные противовоспалительные препараты, неоадъювантную химиотерапию.
После удаления препарата желудок вскрывали по большой кривизне. Выполняли биопсию опухоли и макроскопически неизмененной СОЖ, отступя 3—5 см от проксимального края опухоли. Взятые образцы тканей помещали в нейтральный формалин. Материал проводили по стандартной методике и заливали в парафин. Срезы толщиной 4—5 мкм окрашивали гематоксилином и эозином и иммуногистохимически, с использованием антител к CD20 (Epitope Specific Rabbit Antibody, Thermo Fisher Scientific) в разведении 1:400. Материал для исследования иммуногистохимическими (ИГХ) методами фиксировали 10% нейтральным формалином в течение 24 ч, заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37 °C в течение 18 ч. Депарафинизацию и демаскировку антигенов проводили в РТ-модуле при температуре 121 °C в течение 20 мин с последующим остыванием 60 мин. В качестве системы визуализации применялась Ultra Vision LP Detection System HRP Polymer & DAB Plus Chromogen. В качестве отрицательного контроля срезы аналогичным образом инкубировали с раствором для разведения антител (UltrAb Diluent). В перитуморальной области полуколичественным методом оценивали наличие очаговых лимфоидных В-клеточных инфильтратов и количество лимфоидных фолликулов (ЛФ) в СОЖ (нет, единичные — не более 2 в поле зрения, множественные — более 2 фолликулов в поле зрения). Также оценивали наличие обычных и атипичных светлых центров в них. Подсчет плотности диффузных В-лимфоцитов осуществляли, используя увеличение 400, на площади 1200×1800 пикс, принятой за условную единицу площади (УЕП), при разрешении 10 пикс/см (0,42×0,28 мм 2 ). Плотность метрической сетки составила 216 точек.
Плотность диффузных CD20 В-лимфоцитов в зависимости от клинических характеристик РЖ представлена в таблице. Наиболее низкие значения плотности отмечены при низкодифференцированной аденокарциноме и недифференцированном РЖ (G3—G4), при глубине инвазии опухоли Т1—2 и при наличии метастазов в регионарных лимфатических узлах (N1—2). Также были отмечены положительные корреляции плотности диффузных CD20 В-лимфоцитов в опухоли с наличием очаговых ЛИ (ρ=0,634, t=3,28, р=0,005). Плотность диффузных СД20 В-лимфоцитов была выше при наличии ЛИ, чем при отсутствии (49,0±15,4 и 22,9±12,1 клеток на УЕП соответственно, р=0,009). Связи этого показателя с выживаемостью больных РЖ и с локализацией опухоли и типом роста не выявлено.

Наличие очаговых ЛИ отрицательно коррелировало с гистологическим типом (гамма =–0,524, Z=–2,02, р=0,04) и общей 3-летней выживаемостью (гамма =–0,770, Z=–2,60, р=0,01). Очаговые Л.И. чаще наблюдались при диффузном типе РЖ, чем при кишечном (в 46,7 и 21,4% случаев соответственно, р=0,15). Несмотря на то что связи этого показателя с глубиной инвазии опухоли и наличием метастазов в регионарных лимфатических узлах не выявлено, наличие очаговых CD20 ЛИ сопровождалось статистически недостоверным снижением 3-летней общей выживаемости с 94,7 до 70,0% (р=0,07). Однако связи очаговых ЛИ с 3-летней безрецидивной выживаемостью пациентов РЖ не отмечено.
Аналогично, количество ЛФ в СОЖ, прилежащей к опухоли, коррелировало с гистологическим типом (гамма=0,509, Z=2,39, р=0,02) и 3-летней безрецидивной выживаемостью (гамма =–0,636, Z=–2,51, р=0,01). Множественные Л.Ф. чаще встречались при диффузном типе РЖ, чем при кишечном (в 72,7 и 38,9% соответственно, р=0,07), и при их наличии отмечено снижение 3-летней безрецидивной выживаемости с 75 до 40%, р=0,08). В то же время связи этого показателя с 3-летней общей выживаемостью не выявлено.
Наличие ЛФ с атипическими светлыми центрами коррелировало только с выраженностью желудочной дисплазии (гамма =0,833, Z=3,22, р=0,001). Чаще всего они выявлялись при тяжелой степени дисплазии желудочного эпителия (в 50,0 и 12,5% соответственно при наличии или отсутствии и тяжелой или умеренной степени дисплазии желудочного эпителия, р=0,02).
Обсуждение
Роль опухолеинфильтрирующих иммунных клеток в прогрессии злокачественных опухолей подтверждена в большом количестве исследований. Полагают, что основные механизмы могут быть связаны с секрецией иммунными клетками цитокинов, хемокинов, факторов роста и протеаз [6, 7, 10], активацией ангиогенеза [4, 5, 11], с участием иммунных клеток в ремодуляции экстрацеллюлярного матрикса, способствующих инвазии опухолевых клеток и метастазированию в отдаленные органы [4, 6]. Роль В-лимфоцитов в опухолевой прогрессии остается малоизученной. Наши результаты свидетельствуют о неоднородности структур, экспрессирующих CD20, в перитуморальной области СОЖ. Они были представлены диффузными В-лимфоцитами, ЛФ и очаговыми Л.И. При этом интересно, что высокая плотность диффузных В-лимфоцитов была статистически значимо связана с начальными стадиями заболевания и не связана с отдаленными результатами лечения РЖ, тогда как наличие очаговых ЛИ и множественных ЛФ было связано с диффузным типом РЖ и ухудшением отдаленных результатов лечения этой патологии.
Данные литературы малочисленны и неоднозначны. Ряд авторов свидетельствуют о том, что повышение количества В-лимфоцитов является прогностически благоприятным признаком, так как связано со специфическим противоопухолевым иммунитетом [12, 13]. Однако другие исследователи отметили, что В-лимфоциты могут способствовать прогрессии злокачественных новообразований. Так, было показано, что в опухолеинфильтрирующих В-лимфоцитах отмечается активация «сигнального белка и активатора транскрипции 3» (STAT3). Известно, что STAT3 играет важную роль в опухолевом ангиогенезе, участвуя в регуляции экспрессии эндотелиального фактора роста сосудов (VEGF) и других про-ангиогенных факторов [14, 15]. Было показано, что плотность опухолеинфильтрирующих В-лимфоцитов прямо коррелирует с уровнями экспрессии VEGF, матричной металлопротеиназы 9 (MMP9) и фактора, индуцируемого гипоксией 1а (HIF1a) [16, 17]. Увеличение уровня В-лимфоцитов с активированным STAT3 было отмечено при раке желудка, легких, печени, простаты и было связано с ухудшением отдаленных результатов лечения [16]. Кроме того, было показано, что В-лимфоциты и сами могут являться источником VEGF-A, играющего ключевую роль в лимфо- и ангиогенезе [18], а В-лимфоциты, экспрессирующие интерлейкин 10, могут способствовать поляризации М1 макрофагов, обладающих противоопухолевой активностью, в М2 макрофаги, обладающие способностью стимулировать рост и метастазирование злокачественных опухолей [19, 20].
Заключение
Таким образом, проведенное исследование позволило установить неоднородность структур, экспрессирующих CD20 в перитуморальной области СОЖ при Р.Ж. Полагаем, что отмеченные корреляции СД20, ЛИ и ЛФ с диффузным типом роста опухоли и отдаленными результатами лечения свидетельствуют о важности дальнейших исследований для изучения роли В-лимфоцитов в прогрессии РЖ.
Лимфоцитарно плазмоцитарная инфильтрация желудка что это такое
Хронический гастрит является наиболее распространенным заболеванием и занимает одно из первых мест в структуре заболеваний тракта. По оценке различных авторов, он встречается у 50–80% населения нашей страны [1, 2]. Открытие Н.pylori австралийскими учеными и в 1983 году явилось поистине революционным и вызвало невероятный прогресс в гастроэнтерологии. Современным интернистам это принесло «понимание того, что микроорганизм H.pylori является важным участником формирования таких патологических состояний, как острый и хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, рак и желудка» [3] и позволило выйти на разработку новых, более эффективных этиопатогенетических принципов лечения и профилактики этих заболеваний.
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной желудка. H.pylori является одним из самых распространенных возбудителей инфекционных заболеваний. Согласно некоторым оценкам, более половины населения мира инфицированы этим микроорганизмом. Инфекция H.pylori часто не имеет клинических проявлений. Только у определенной части инфицированных с течением времени развивается хронический атрофический гастрит и рак желудка. В 2005 году первооткрыватели бактерии — Робин Уоррен (Robin Warren) и Барри Маршал (Barry Marshall) — были удостоены Нобелевской премии по физиологии и медицине «за открытие бактерии Helicobacter pylori и ее роли в развитии гастрита и язвы желудка». Интенсивное изучение H.pylori показало, что у 80% больных, страдающих раком желудка, в анамнезе была зафиксирована инфекция H. pylori. Это явилось одной из причин, по которым в 1995 году Международная ассоциация по изучению рака (IARC, ВОЗ) признала H.pylori канцерогеном I класса.
Новые европейские рекомендации по инфекции H.pylori, представленные на очередном XXIV заседании Международной рабочей группы по изучению Helicobacter pylori и родственным бактериям при хронических воспалительных процессах пищеварительного тракта и раке желудка (XXIVth International Workshop on Helicobacter and related bacteria in chronic digestive inflammation and gastric cancer) 11–13 cентября 2011 года, были посвящены не только новым подходам к терапии, но и современным методам диагностики инфекции Н.pylori. Эти методы делятся на инвазивные и неинвазивные. Все инвазивные методы диагностики предусматривают проведение эндоскопического исследования с забором биопсийного материала — биоптатов слизистой оболочки желудка. Эндоскопическое исследование является одним из самых важных методов оценки слизистой оболочки желудка у пациентов с H.pylori ассоциированной патологией. Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Неинвазивные методы — это различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена Н.pylori в фекалиях, ПЦР исследование с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест с С13 или С14 меченным атомом углерода.
История открытия Helicobacter pylori
Таблица 1. Распространенность инфекции H.pylori и смертность от рака желудка в странах с различным уровнем
| Страна | Инфицированность H. pylori, % | Смертность (рак желудка) |
| Китай Россия и Япония | 80-100 60-80 | Более 30 человек на 100 000 населения |
| Алжир Коста-Рика Кот-Дивуар Нигерия Чили Эквадор | 75-95 | Более 30 человек на 100 000 населения |
| Австралия Бельгия Великобритания Израиль Канада Новая Зеландия США Франция | 4 5 9 15 13,6 5 23 20 | Менее 10 человек на 100 000 населения |
Приведенные данные свидетельствуют о более высокой заболеваемости раком желудка в тех регионах, где выше показатели заболеваемости H.pylori ассоциированным гастритом.
Современные методы лабораторной диагностики инфекции Helicobacter pylori
С момента открытия Н.pylori прошло чуть более тридцати лет. За этот период времени было разработано большое количество методов лабораторной диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Однако в настоящее время ни один из существующих методов лабораторной диагностики инфекции Н.pylori не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую, зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции. Все существующие на сегодняшний день методы лабораторной диагностики инфекции Н.pylori делятся на две большие группы: инвазивные и неинвазивные методы (табл. 2).
Таблица 2. Методы лабораторной диагностики инфекции Н.pylori
| Инвазивные методы | Неинвазивные методы |
| Бактериологический метод Гистологический метод Молекулярно-биологический метод (ПЦР) Фазово-контрастная микроскопия Быстрый Уреазный тест | Серологический метод Молекулярно-биологический метод (ПЦР) Уреазный дыхательный тест |
Принципиальное значение для практики имеет проведение диагностики Н.pylori инфекции до лечения (первичная диагностика), и после проведения противохеликобактерной терапии (контроль эффективности выбранной схемы лечения). Первичная диагностика Н.pylori инфекции должна осуществляться методами, непосредственно выявляющими бактерию или продукты ее жизнедеятельности в организме больного. Таким требованиям удовлетворяют следующие методы диагностики:
1. Бактериологический метод — посев биоптата слизистой оболочки желудка или двенадцатиперстной кишки на среду с целью выделения чистой культуры Н.pylori.
2. Дыхательный тест — определение в выдыхаемом больным воздухе изотопов С13 или С14, которые выделяются в результате расщепления в желудке больного меченой мочевины под действием фермента уреазы Н.pylori.
3. Быстрый Уреазный тест — определение уреазной активности в биоптате слизистой оболочки желудка или двенадцатиперстной кишки путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
4. Гистологический метод — золотой стандарт диагностики Н.pylori инфекции и хронического гастрита.
Бактериологический метод является единственным методом исследования, обладающим 100% специфичностью. Он позволяет выделить чистую культуру Н.pylori, провести ее идентификацию, изучить морфологические, биохимические и биологические свойства бактерий. В эпидемиологической практике выделение чистой культуры Н.pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием инфекции, которое может быть обусловлено тем же штаммом. В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Н.pylori и изготовлять препараты для серологической диагностики. Как и любой метод диагностики, бактериологический метод исследования обладает не только достоинствами, но и недостатками, которые зачастую ограничивают его широкое использование в клинической практике. К недостаткам этого метода относятся, прежде всего, необходимость специального лабораторного оборудования, реактивов, специальных питательных сред, а также обученных специалистов. Все это сопряжено с большими материальными затратами. Результаты бактериологического исследования отсрочены от момента взятия биопсийного материала минимум на 3–5 дней, а при необходимости получения данных о чувствительности Н.pylori к антибактериальным препаратам длительность исследования увеличивается и составляет в среднем 6–7 дней. Кроме того, для проведения бактериологического исследования необходимо проведение эзофагогастродуоденоскопии с забором биопсийного материала.
Быстрый урезаный тест основан на определении в биоптате слизистой оболочки желудка местной уреазной активности H.pylori. Быстрота изменения окраски индикатора (с желтого цвета на красный или малиновый) зависит от уреазной активности, которая в свою очередь зависит от количества бактерий. К недостаткам теста относится его инвазивность, невозможность морфологической оценки состояния слизистой оболочки желудка, а также получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных результатов (контаминирование материала другими уреазопродуцентами, например H.heilmannii — спиралевидной бактерии рода Helicobacter, которую возможно обнаружить у 0,25% пациентов при проведении гастроскопии [12]).
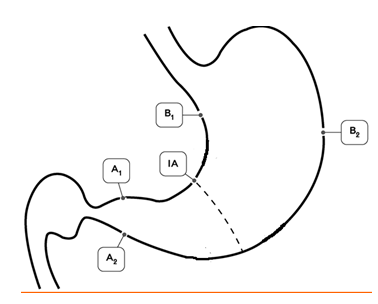
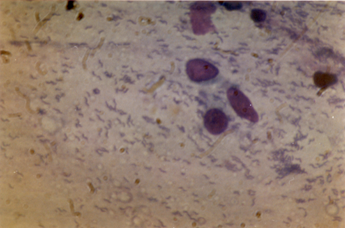
Гистологический метод — золотой стандарт диагностики инфекции H.pylori, который является наиболее объективным методом, так как позволяет обнаружить возбудитель инфекции, определить положение бактериальных тел в слизи, покрывающей слизистую оболочку желудка, наблюдать взаимоотношение Н.pylori с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия бактерии с тканями макроорганизма (рис. 2). Забор биопсийного материала производится из зон слизистой оболочки желудка с признаками наиболее активного воспалительного процесса (максимально выраженная гиперемия и отeк). Биопсия и забор материала для диагностики инфекции из области дна язв и эрозий, а также из их краев, является ошибкой, так как в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации Н.pylori. Поскольку бактерии Н.pylori могут быть распределены неравномерно в различных отделах желудка, для повышения чувствительности метода, а также для оценки состояния слизистой оболочки и определения типа и локализации гастрита, степени его выраженности биоптаты целесообразно брать из антрального, фундального отделов, а также области угла желудка (рис. 1).
Рисунок 1. Схема выполнения биопсии слизистой оболочки желудка с целью достоверной диагностики инфекции H.Pylori и гастрита в пяти зонах желудка: две биопсии — в антральном отделе (А1 и А2), две биопсии — в теле желудка (В1 и В2) и одна биопсия в зоне угла желудка (IА).
Рисунок 2. Диагностика инфекции Н.pylori при окраске гистологического препарата красителем акридиновым оранжевым, бактерии определяются в виде мелких, слегка извитых палочек, находящихся в слое слизи над поверхностью эпителия желудка в непосредственной близости от слизистой оболочки желудка и на поверхности эпителиальных клеток.
Классификация количественной и качественной оценки инфекции H. pylori, степени воспаления при гастрите, атрофии и кишечной метаплазии была предложена в Сиднейской системе и ее Хьюстонской модификации, однако эта система не позволяла оценивать прогноз повреждения. Современная классификация и оценка степени и стадии гастрита OLGA (Operative Link for Gastritis Assessment) основана на оценке стадийности и степени выраженности атрофического гастрита в фундальном и антральном отделах желудка [13, 14]. Под степенью гастрита понимается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Чем выше выраженность атрофии и больше объем поражения слизистой оболочки желудка, тем выше риск развития неоплазии. Таким образом, новая система определения стадии гастрита OLGA обеспечивает определение прогноза развития предраковых изменений, позволяет клиницисту получить представление о распространенности повреждения слизистой оболочки желудка и степени риска развития рака желудка [15, 16].
В последние годы в клинической практике начал использоваться серологический скрининг заболеваний желудка, включающий определение в сыворотке крови антител класса G к H.pylori (.pylori IgG), пепсиногена I (РG1) и гастрина 17 (G17). Анти- H.pylori IgG являются наилучшим маркером наличия гастрита и обладают высокой чувствительностью и низкой специфичностью в диагностике атрофического гастрита. РG1 и G17 указывают на наличие атрофического гастрита с высокой специфичностью и низкой чувствительностью. Комбинация этих трех тестов (Гастропанель, Биохит, Финляндия) обладает высокой чувствительностью (83%) и специфичностью (95%) в диагностике атрофического гастрита [17]. В проведенном на базе Ярославской областной клинической онкологической больницы и Медицинском центре диагностики и профилактики (г. Ярославль) исследовании, заключавшемся в определении у больных ранним раком желудка и мультифокальным атрофическим гастритом, была обнаружена функциональная недостаточность слизистой оболочки тела желудка (низкий уровень PG1), полученные значения PG1 в этих группах пациентов были достоверно ниже по сравнению с группами больных антральным атрофическим и неатрофическим гастритами. Это свидетельствует о том, что сывороточный PG1 может рассматриваться в качестве маркера риска развития рака желудка. При атрофии антрального отдела желудка происходит снижение выработки постпрандиального G17. Серологический метод с определением G17, РG1 и анти H. pylori IgG может служить методом скрининга атрофического гастрита и рака желудка в крупнопопуляционных исследованиях ввиду его очевидных преимуществ — удобства и безопасности для пациента наряду с высокой эффективностью. Использование серологического теста для выявления предопухолевой патологии и рака желудка на ранних стадиях может способствовать улучшению своевременной диагностики данной патологии, что в итоге должно положительным образом сказаться на уровне заболеваемости и смертности [18].
Генотипирование Helicobacter pylori
Новые эндоскопические технологии диагностики хронического гастрита, ассоциированного с H.pylori
Эндоскопическое исследование — один из самых важных методов оценки слизистой оболочки желудка. Применение дополнительных методик и техник, таких как эндоскопия в узком спектре света, эндоскопия с оптическим увеличением изображения, хромоэндоскопия, позволяют детально изучить структурные особенности слизистой оболочки желудка.
Увеличительная эндоскопия
Первое эндоскопическое исследование с применением оптического увеличения эндоскопического изображения желудка было выполнено еще в 1967 году в Японии (Okuyama) [24]. Это послужило отправной точкой для развития новых эндоскопических технологий, направленных на изучение мельчайших структур поверхности слизистой оболочки. В настоящее время существует два способа увеличения — электронное и оптическое. Изображение, полученное при помощи электронного увеличения, имеет такое же разрешение, как и обычное эндоскопическое изображение. В то время как при применении оптического увеличения становятся видимыми мельчайшие детали, которые невозможно обнаружить при обычном исследовании. Эндоскопы с увеличением оснащены с подвижными линзами в дистальной части аппарата и по своей функциональности сопоставимы с обычными световыми микроскопами. Довольно часто эндоскопическое исследование с увеличением применяется совместно с хромоскопией. Однако применение красителей не позволяет визуализировать микрососудистую архитектонику, что очень важно в дифференциальной диагностике неопластических изменений, к тому же эта дополнительная манипуляция увеличивает время исследования.
Узкоспектральная эндоскопия (narrow band imaging — NBI) — это новая оптическая диагностическая методика, которая основана на использовании специальных оптических фильтров, суживающих спектр световой волны. Обычные эндоскопические системы используют практически весь видимый световой спектр от 400 до 800 нм. Новая система использует преимущества в основном двух световых волн длиной 415 и 445 нм в диагностике сосудистых структур слизистой оболочки пищеварительного тракта, так как эти световые волны хорошо поглощаются гемоглобином. Таким образом, световые фильтры позволяют получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака. Кроме этого, новая эндоскопическая система повышает контрастность изображения, что создает эффект виртуальной хромоскопии. С технической точки зрения применение функции узкого спектра света в желудке без оптического увеличения нецелесообразно в связи с тем, что получаемое изображение оказывается слишком темным и «шумным». Это происходит того, что при растяжении стенок желудка воздухом во время исследования его просвет становится слишком большим. Поэтому гораздо важнее и актуальнее проводить исследование в узком спектре света совместно с увеличением [25]. Первоначально хромоскопия и эндоскопия в узком спектре света в комбинации с увеличением применялись для оценки раннего рака желудка перед эндоскопической резекцией слизистой оболочки. С дальнейшим внедрением этих технологий в клиническую практику методики оценки микрососудистой архитектоники и микроструктуры поверхности слизистой оболочки стали успешно применятся для диагностики многих других патологических состояний желудка, таких как H.pylori ассоциированный гастрит, кишечная метаплазия, атрофия [26].
Нормальная слизистая оболочка желудка
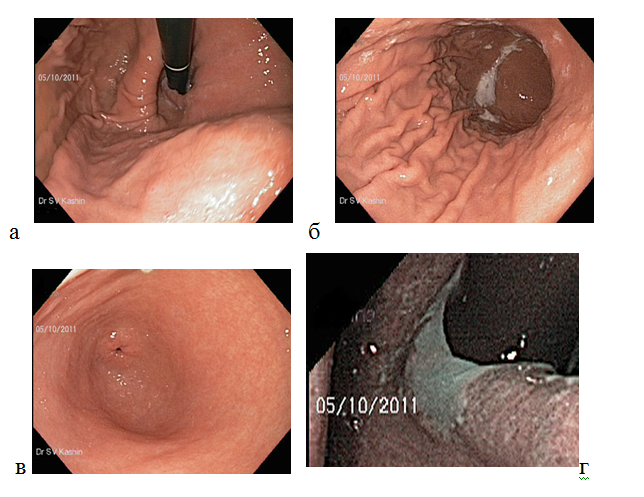
В желудке выделяют четыре анатомических зоны: кардия, фундальный отдел (дно желудка), тело желудка, пилорический (антральный) отдел. Поверхность слизистой оболочки всех отделов желудка выстлана однослойным призматическим железистым эпителием. Для рельефа внутренней поверхности желудка характерно наличие трех видов образований — продольных желудочных складок, желудочных полей и желудочных ямочек. Желудочные складки (plicae gastricae) образованы слизистой оболочкой и подслизистой основой. Желудочные поля (areae gastricae) представляют собой отграниченные друг от друга бороздками участки слизистой оболочки. Они имеют многоугольную форму и размер поперечника от 1 до 16 мм. Наличие полей объясняется тем, что железы желудка располагаются группами, отделенными друг от друга прослойками соединительной ткани. Поверхностно лежащие вены в этих прослойках просвечивают в виде красноватых линий, выделяя границы между полями. Желудочные ямочки (foveolae gastricae) — это углубления эпителия в собственной пластинке слизистой оболочки. Они встречаются по всей поверхности желудка. Число ямочек в желудке достигает почти трех миллионов. Желудочные ямочки имеют микроскопические размеры, но величина их неодинакова в различных отделах желудка. В кардиальном отделе и теле желудка их глубина составляет всего ¼ толщины слизистой оболочки. В пилорической части желудка ямочки более глубокие. Они занимают около половины толщины всей слизистой оболочки [27]. При обычном эндоскопическом исследовании нормальная слизистая оболочка желудка цвета, ее цвет зависит от степени васкуляризации и растяжения — чем больше растяжение, тем бледнее слизистая оболочка. Слизистая оболочка имеет мелкозернистую поверхность благодаря наличию желудочных полей (рис. 4) [28].
Рисунок 4. Нормальная слизистая оболочка тела желудка при стандартном осмотре в белом световом режиме. Вид тела желудка (а) при инверсии (изгибе дистального конца эндоскопа на 180о) и (б) — при прямом осмотре эндоскопом; (в) — слизистая оболочки антрального отдела желудка; (г) — осмотр в узкоспектральном режиме: более контрастное изображение поверхности слизистой оболочки кардиального и субкардиального отделов желудка, мелкозернистая структура эпителия, четкая граница с плоским эпителием пищевода (указана стрелками).
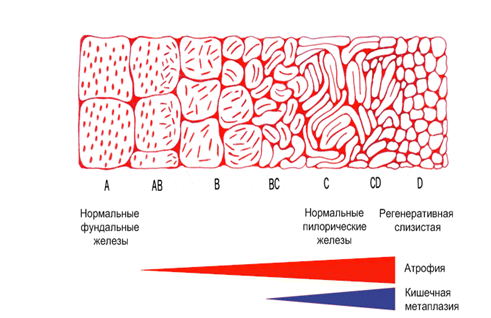
Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Однако следует отметить, что применение этих технологий не может полностью обеспечить различение абсолютно нормальной слизистой оболочки от гастрита с минимальными изменениями. При осмотре слизистой оболочки с увеличением оцениваются две основные характеристики — микроструктура поверхности слизистой оболочки (ямочный рисунок — pit pattern) и микрососудистая структура (рисунок субэпителиальной капиллярной сети (subepithelial capillary network — SECN). Более тридцати лет назад Sakaki предложил классификацию типов рисунка слизистой оболочки желудка при использовании фиброскопа с увеличением в 30 раз. Согласно этой классификации (рис. 5), выделяют чистые типы (А, В, С, D) и смешанные типы (АВ, ВС, CD). Типы, А и В соответствуют нормальной слизистой оболочке. Дальнейшие изменения рисунка ямок свидетельствуют о более выраженных предопухолевых изменениях, таких как атрофия и кишечная метаплазия (показаны красной и синей полосами в нижней части рисунка). Для диспластических изменений и опухолевого процесса типы рисунка могут соответствовать С (полосатый тип) и D (нерегулярный, зернистый, ячеистый рисунок) типам рисунка.
А — точечные ямки (dotted pits)
В — короткие линейные ямки (short linear pits)
С — полосатые борозды (striped grooves)
D — ячеистые борозды ( grooves)
Рисунок 5. Схема классификации типов рисунка поверхности слизистой оболочки желудка при увеличительной эндоскопии (по Sakaki).
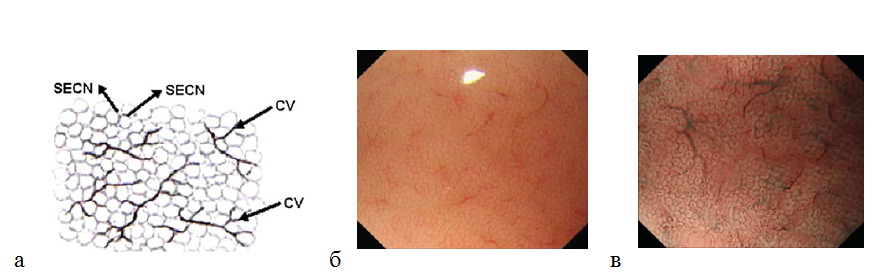
Оценивая микрососудистую архитектонику в теле желудка, можно определить рисунок субэпителиальной капиллярной сети (SECN) в виде пчелиных сот ( network) с коллекторными венулами. Полигональные петли субэпителиальных капилляров окружают каждую желудочную ямку, формируя под эпителием сеть в виде пчелиных сот. Далее ветви сосудистой сети сходятся в коллекторные венулы. При осмотре в узкоспектральном режиме с оптическим увеличением изображения микроструктура поверхности слизистой оболочки становиться более отчетливой: определяются ямки округлой или овальной формы. Ямки гистологически соответствуют желудочным железам. Коллекторные венулы (CV) располагаются глубже, чем субэпителиальная капиллярная сеть, поэтому при осмотре в узком спектре света имеют более насыщенный зеленый цвет. Так как в режиме NBI участки с большей васкуляризацией становятся темными, наблюдается специфическая картина слизистой оболочки тела желудка: светлые участки окружены темным ободком [29] (рис. 6). Правильная форма и взаиморасположение сосудов и структур слизистой оболочки являются наиболее важными ее характеристиками для дифференцировки нормальной и патологически измененной слизистой оболочкой желудка.
Рисунок 6. (а) — рисунок (схема) субэпителиальной капиллярной сети (SECN) в виде пчелиных сот с коллекторными венулами (CV); (б) — нормальная слизистая оболочка тела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: субэпителиальный капиллярный рисунок в виде пчелиных сот с коллекторными венулами; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо видны желудочные ямки округлой или овальной формы, сосудистый рисунок.
Нормальная слизистая оболочка в антральном отделе
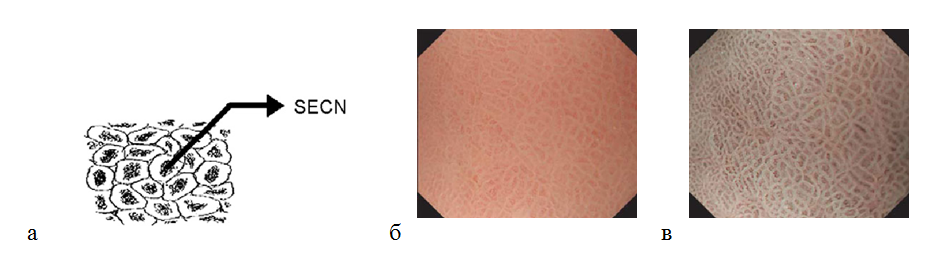
Слизистая оболочка антрального отдела желудка имеет другую картину. При исследовании микрососудистой архитектоники определяется кольцеобразная () субэпителиальная капиллярная сеть. Коллекторные венулы визуализируются реже, так как они находятся в более глубоких частях собственной пластинки, в отличие от тела желудка. Ямки имеют линейный или сетчатый рисунок. Каждый субэпителиальный капилляр расположен в апикальной части желудочной ямки в виде кольца, которое разделяется линейными или сетчатыми бороздками. В отличие от слизистой оболочки тела желудка, в антральном отделе более темные участки окружены светлым ободком (рис. 7). По размерам эти структуры в антральном отделе больше, чем в теле желудка.
Рисунок 7. (а) — кольцеобразная субэпителиальная капиллярная сеть (SECN) в антральном отделе желудка; (б) — нормальная слизистая оболочка антрального отдела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: кольцеобразный субэпителиальный капиллярный рисунок; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо определяется кольцеобразный субэпителиальный капиллярный рисунок и сетчатая микроструктура поверхности слизистой оболочки.