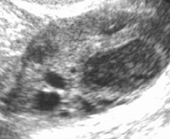
лютеинизация неовулировавшего фолликула что это
Фолликулометрия
Фолликулометрия – это ультразвуковое исследование, которое позволяет осуществлять контроль за ростом и развитием фолликулов в яичниках на протяжении менструального цикла.
Мониторинг фолликулогенеза дает возможность оценить не только функцию яичников, но и дает представление о росте эндометрия и его соответствии менструальному циклу. Фолликулометрия используется в программах ЭКО.
Цели фолликулометрии
Физиология фолликулогенеза
Первым днем менструального цикла принято считать первый день начала менструации. После этого под воздействием фолликулостимулирующего гормона (ФСГ) в яичниках начинают развиваться одновременно несколько фолликулов. Однако уже очень скоро один из них (значительно реже два или более) начинает опережать в развитии остальные – это доминантный фолликул. На этом этапе его размеры превышают 1,5 сантиметра, а другие фолликулы подвергаются обратному развитию (атрезии). Изменения размеров доминантного фолликула ежедневно составляют примерно 2-3 миллиметра и к моменту овуляции, которая происходит под воздействием пика выброса лютеинизирующего гормона, он имеет в диаметре в среднем от 1,75 до 2,4 сантиметров. После овуляции начинается процесс формирования желтого тела – временной эндокринной железы, вырабатывающей прогестерон, которая в случае оплодотворения яйцеклетки и успешной имплантации эмбриона поддерживает беременность до формирования плацентарной ткани.
Преимущества УЗИ исследования в Нова Клиник
В какие дни цикла проводится фолликулометрия (мониторинг фолликулогенеза)?
При 28-ми дневном цикле первое УЗИ проводится непосредственно после прекращения менструальных выделений, то есть на 3-5 день цикла.
Следующий мониторинг фолликулогенеза для оценки роста фолликулов назначается через 5-7 дней (соответственно, при более длинном цикле исследование проводится позже).
Далее фолликулометрия осуществляется регулярно через каждые 1-2 дня. В зависимости от полученных результатов дата следующего посещения клиники может немного варьироваться. Исследование проводится либо до того момента, когда врач увидит признаки произошедшей овуляции, либо до начала менструальных кровотечений, если в данном цикле овуляция не произошла.
При проведении фолликулометрии крайне важна регулярность и тщательность осмотров – ведь обнаружение доминантного фолликула на 7-8 день менструального цикла, а затем желтого тела на его месте через 7 дней не являются гарантией функционально полноценной овуляции.
Результаты фолликулометрии
К каким выводам относительно роста и развития фолликулов может прийти врач на основании фолликулометрии?
Нормальная овуляция
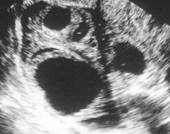
Помимо этого, маркером овуляции считается повышение уровня прогестерона в крови спустя 5-7 суток после овуляции.
При выявлении в процессе фолликулометрии таких результатов, можно сделать вывод, что менструальный цикл является овуляторным, и, теоретически, в нем возможно наступление беременности.
Все остальные варианты фолликулометрии должны рассматриваться как ановуляторные менструальные циклы. Однако выявление ановуляторного цикла само по себе не является признаком патологии – в норме у здоровых женщин около 15% менструальных циклов проходят без овуляции (в среднем 2 цикла в год). При регулярных ановуляторных циклах вероятность наступления спонтанной беременности резко снижается, поскольку ановуляция является наиболее распространенной причиной эндокринного бесплодия.
Ановуляторные циклы, выявляемые при фолликулометрии
Ановуляция (отсутствие овуляции в менструальном цикле) может быть обусловлена различными причинами, среди которых СПКЯ, эндокринные заболевания, гиперандрогения, истощение яичников и др. Ниже приведены варианты ановуляторных циклов, выявляемые с помощью фолликулометрии:
Отсутствие развития фолликулов
Отсутствует динамика развития фолликулов на всем протяжении цикла, отсутствует доминантный фолликул и овуляция.
Кроме того, по результатам анализа крови отмечается низкий уровень прогестерона, соответствующий первой фазе цикла.
Такая ситуация встречается при некоторых эндокринных патологиях, наиболее часто – при синдроме поликистозных яичников (СПКЯ)
Атрезия доминантного фолликула
Характеризуется уменьшением размеров неовулировавшего доминантного фолликула в динамике. В данной ситуации врач видит доминантный фолликул, который сначала нормально растет, но потом останавливается в развитии (как правило, не достигнув достаточных размеров для овуляции) и регрессирует (уменьшается). Овуляции не происходит.
Подобные состояния развиваются вследствие снижения выработки фолликулостимулирующего и лютеинизирующего гормонов. По этой причине полного созревания фолликул не достигает.
Персистенция доминантного фолликула
Персистенция фолликула – ситуация, при которой фолликул, достигнув зрелости, не претерпевает дальнейших физиологических превращений и продолжает существовать и функционировать на протяжении всего цикла, выделяя эстрогены. В данной ситуации врач наблюдает доминантный фолликул, который увеличивается до нужных размеров, однако разрыва фолликула не происходит (отсутствует овуляторный пик ЛГ). Этот фолликул может сохраняться и после наступления менструации (в следующем менструальном цикле).
В крови определяется низкий уровень прогестерона, соответствующий первой фазе цикла, повышенный уровень эстрогенов.
Фолликулярная киста
При дальнейшем росте неовулировавшего фолликула происходит уплотнение его стенок, внутри накапливается жидкость и образуется киста размером более 2,5 сантиметров в диаметре. В данной ситуации врач определяет доминантный фолликул, который развивается до необходимых размеров, но разрыва фолликула не происходит (отсутствует овуляторный пик ЛГ),он и далее увеличивается, образуя фолликулярную кисту. Размеры таких кист могут достигать 6-8 см и более. Подобные кисты, как правило, не требуют назначения медикаментозной терапии, и регрессируют самостоятельно в течение 1-2 менструальных циклов.
В крови определяется низкий уровень прогестерона, соответствующий первой фазе цикла, и повышенный уровень эстрогенов.
LUF – синдром характеризуется преждевременной лютеинизацией предовуляторного фолликула без овуляции, циклическими изменениями секреции прогестерона и несколько запоздалой секреторной трансформацией эндометрия. Причиной такой патологии могут являться нарушения деятельности ЦНС, гормональные дисфункции (гиперандрогения, гиперпролактинемия), хронические воспалительные процессы в половых органах, обменные нарушения.
При проведении фолликулометрии врач определяет доминантный фолликул, который развивается, но разрыва фолликула не происходит – вместо овуляции происходит его лютеинизация (из-за преждевременного повышения ЛГ).
В крови отмечается уровень прогестерона, соответствующий норме второй фазы.
По результатам фолликулометрии в течение одного или нескольких менструальных циклов врач делает заключение о функциональном состоянии яичников. При выявленных нарушениях назначается необходимая гормональная терапия в зависимости от заданных целей – для коррекции менструального цикла, либо для наступления беременности. При выявленном овуляторном менструальном цикле и недостаточности лютеиновой фазы цикла врач может рекомендовать назначение препаратов прогестерона; при ановуляторных менструальных циклах – индукцию (стимуляцию) овуляции. При наличии эндокринного бесплодия, вызванного ановуляцией, когда индукция овуляции в течение нескольких циклов не принесла ожидаемого эффекта, вариантом выбора является ЭКО.
Стоимость фолликулометрии
Цены на проведение фолликулометрии в Москве могут быть различны и зависят от медицинского центра, где осуществляется исследование. Стоимость фолликулометрии в Нова Клиник вы можете посмотреть в разделе «Цены». УЗИ проводится врачами ультразвуковой диагностики с большим опытом работы в сфере акушерства и гинекологии на аппаратах экспертного класса.
Где сделать фолликулометрию в Москве?
Вы можете сделать фолликулометрию в Нова Клиник в удобное для Вас время, предварительно записавшись по телефону, указанному на сайте, или воспользовавшись кнопкой записи.
Ановуляция и недостаточность лютеиновой фазы
Фанченко Н.Д., Иванец Т.Ю.
ФГБУ «НЦАГиП им. В.И.Кулакова» Минздравсоцразвития России, Москва
Проблемы изучения и коррекции нарушений репродуктивной функции в настоящее время приобретают не только медицинское, социально-демографическое, но и экономическое значение. Среди супружеских пар детородного возраста бесплодие во многих странах, в том числе и в России, достигает 15%. Женский фактор бесплодия составляет более 50% в структуре бесплодия у супружеских пар. Бесплодие является симптомом самых разнообразных нарушений соматического и психического здоровья и возникает на фоне системных заболеваний (эндокринных, инфекционных, аутоиммунных, психосоматических). К нарушению генеративной функции могут привести резкие изменения массы тела, повреждения ткани гонад в результате лечения онкозаболеваний (радиотерапия, химиотерапия), хронический стресс, интенсивные занятия спортом и т.д (1,5,20).
Соответственно, перед клиницистами, занимающимися восстановлением репродуктивного здоровья с применением современных вспомогательных медицинских технологий (ВРТ), встала проблема диагностики конкретных причин бесплодия (1,4). Это потребовало разработки алгоритма обследования супружеских пар и лабораторного мониторинга процесса терапии (10,13). В данной статье основное внимание уделяется современным методам лабораторного обследования женщин, нуждающихся в восстановлении генеративной функции.
Гормональная регуляция менструального цикла
Нормальный менструальный цикл обеспечивается функционированием трех основных компонентов: аркуатных ядер гипоталамуса, гонадотрофов гипофиза и фолликулов яичников (14,16,18). Аркуатные ядра секретируют в портальную систему гонадолиберин приблизительно один раз в час. Гонадолиберин, взаимодействуя со специфическими рецепторами, расположенными на поверхности гонадотрофов, стимулирует синтез, накопление и высвобождение лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов. Высвобождение ЛГ и ФСГ из гипофиза происходит в импульсном режиме с частотой приблизительно 1 импульс в час (15,16). Гонадотропины в яичниках регулируют рост фолликулов и синтез половых гормонов. Половые гормоны яичника, в свою очередь, оказывают воздействие на гормон-секретирующую систему гипофиза, и тем самым, синхронизируют гормональные профили на протяжении менструального цикла (7). В начале фолликулиновой фазы цикла вступившие в рост под воздействием ФСГ фолликулы яичника увеличиваются в объеме, что сопровождается повышением концентрации секретируемого эстрадиола (Е2) (17). Кроме того, растущие фолликулы начинают синтезировать ингибин. Этот процесс продолжается в среднем 12 – 14 дней. В свою очередь эстрадиол и ингибин непосредственно воздействуют на гонадотрофы гипофиза и ингибируют продукцию ЛГ и ФСГ (отрицательная обратная связь). Если концентрация эстрадиола в крови поддерживается выше некоторой пороговой величины – 700 пмоль/л приблизительно в течение 36 – 48 часов, то его ингибирующее действие на гонадотрофы гипофиза прекращается и эстрадиол начинает стимулировать возникновение овуляторного пика гонадотропинов. Этот так называемый эффект положительной обратной связи направлен на гонадотрофы гипофиза.В ответ на увеличение концентрации гонадотропинов завершается созревание доминантного фолликула, происходит овуляция и начинается формирование желтого тела. В течение лютеиновой фазы менструального цикла концентрация гонадотропинов, циркулирующих в крови, приблизительно такая же, как и в фолликулиновую фазу. Прогестерон, вырабатываемый клетками желтого тела, а также ингибин воздействуют на гипоталамус и гонадотрофы гипофиза, тем самым опосредованно ингибируют развитие фолликулов (19). Желтое тело, образующееся на месте разорвавшегося фолликула, играет роль самостоятельной эндокринной железы, основная функция которой заключается в продукции прогестерона, эстрогенов и ингибина. Максимальная активность желтого тела отмечается в середине лютеиновой фазы. В конце нефертильного цикла желтое тело регрессирует. Установлено, что помимо ЛГ и ФСГ на функциональную активность гонад могут оказывать влияние пролактин, гормоны коры надпочечников и щитовидной железы.
Для обеспечения нормальной функциональной активности яичников необходим строго определенный уровень пролактина. Высокие концентрации этого гормона могут оказывать ингибирующее воздействие на процессы фоликулогенеза, снижать секреторную активность желтого тела.
Во многих случаях нарушения системы гипоталамус-гипофиз-гонады обусловлены патологией коры надпочечников. Часто наблюдается функциональная гиперандрогения, при которой повышается секреция дегидроэпиандростерона (ДГЭА), дегидроэпиандростерона-сульфата (ДГЭА-С) и тестостерона, при этом нет изменений активности ферментов стероидогенеза (9,12). В отличие от функциональной гиперандрогении врожденная гиперплазия коры надпочечников (адреногенитальный синдром, АГС) возникает вследствие врожденных генетически обусловленных дефектов ферментных систем, обеспечивающих синтез кортизола (F).
Если эти дефекты присутствуют, даже у гетерозиготных носителей соответствующих мутаций повышенное содержание андрогенов в крови сопровождается повышением уровня 17-гидроксипрогестерона (17-ОП). Диагностика АГС основана на измерении концентрации 17-ОП в крови после введения кортикотропина (проба с АКТГ) (20).Нарушения функции щитовидной железы (гипо- и гипертиреоз), также являются факторами, препятствующими реализации репродуктивной функции как у мужчин, так и у женщин.Исходя из приведенных выше закономерностей для установления причин дисфункции яичников необходимо получение данных о концентрации таких гормонов как ЛГ, ФСГ, тиреотропного гормона (ТТГ), пролактина, эстрадиола, тестостерона, гормонов коры надпочечников (кортизол, ДГЭА-С, 17-ОП) и гормонов щитовидной железы (трийодтиронин – Т3, тироксин – Т4 и их свободные формы).
Ановуляция и недостаточность лютеиновой фазы
Для дифференциальной диагностики овуляторных и неовуляторных менструальных циклов достаточно определения концентрации прогестерона в середине лютеиновой фазы цикла. При ановуляторном цикле сохраняются циклические кровотечения (менструации), но не происходит овуляции и формирования желтого тела, в связи с чем концентрация прогестерона значительно ниже нормативной.Недостаточность лютеиновой фазы (НЛФ) – нарушение функциональной активности желтого тела – наблюдается у половины всех панциенток с дисфункцией яичников и характеризуется более низкой концентрацией прогестерона на 21 – 23 день менструального цикла по сравнению с таковой при наличии активно функционирующего желтого тела.
Однако, учитывая тот факт, что у здоровых фертильных женщин репродуктивного возраста далеко не все циклы могут быть овуляторными, при обнаружении низкой концентрации прогестерона определение уровня этого гормона необходимо повторить на 21 – 23 день трех последовательных менструальных циклов. Отсутствие выраженного повышения концентрации прогестерона в середине лютеиновой фазы трех последовательных менструальных циклов свидетельствует о НЛФ или ановуляции в зависимости от уровня прогестерона (5,6,11).
Для установления причин НФЛ или отсутствия овуляции необходимо определение концентрации ТТГ, ПРЛ, ЛГ, ФСГ, Е2, Т, F, ДГЭА-С и гормонов щитовидной железы (Т3, Т4) в раннюю (2 – 3 день) фолликулиновую фазу менструального цикла.
Выявленные и адекватно скорректированные нарушения функции щитовидной железы, как правило, приводят к восстановлению функции яичников и, тем самым, способности к репродукции.
При гиперпролактинемии пациентку направляют на соответствующее обследование для исключения или подтверждения наличия опухоли гипофиза. При проведении адекватной терапии и нормализации уровня пролактина способность к репродукции, как правило, восстанавливается. При нормальном уровне пролактина следует обратить внимание на концентрацию белковых (ЛГ, ФСГ) и стероидных (Е2,Т, F, ДГЭА-С) гормонов.
Высокий уровень гонадотропинов при низком уровне эстрадиола свидетельствует о первичном поражении гонад – ситуации, неблагоприятной для терапии. Наоборот, низкий уровень гонадотропинов указывает на центральный генез заболевания и позволяет предположить эффективность применения заместительной гормональной терапии.
Аменорея
Первым диагностическим тестом при аменорее для исключения беременности или опухолей является определение концентрации хорионического гонадотропина (ХГЧ).
Для выявления нарушений в системе гипоталамус/гипофиз необходимо определение концентрации пролактина, для исключения гиперандрогении – тестостерона и ДГЭА-С, а для исключения патологии тиреоидной системы – концентрации ТТГ и гормонов щитовидной железы. Если результаты этих определений не отличаются от нормативных показателей, целесообразно провести пробу с прогестероном.
При первичной аменорее наиболее важным лабораторным тестом является определение ФСГ, т.к. первичные нарушения функции гонад сопровождаются высоким уровнем ФСГ в крови. Желательно одновременно определять и концентрацию ЛГ, так как повышенный уровень ЛГ позволит подтвердить диагноз, особенно если соотношение концентраций ЛГ/ФСГ Алгоритм обследования бесплодных пар
Следует особо отметить, что лабораторное диагностическое обследование пациентов (супружеских пар), нуждающихся для восстановления фертильности в использовании вспомогательных репродуктивных технологий (стимуляция овуляции, искусственная инсеминация, экстракорпоральное оплодотворение) не может ограничиться только обследованием состояния репродуктивной системы. Известно, что бесплодие не заболевание, а состояние, являющееся симптомом многих соматических заболеваний и нарушений регуляторных процессов на уровне гипоталамуса.
Расширенный алгоритм первичного обследования бесплодных пациенток включает определение состояния репродуктивной системы (гонадотропины, эстрадиол, тестостерон), тиреоидной системы, адреналовой системы (кортизол, ДГЭА-С), соматотропной и пролактинсекретирующей функций гипофиза (10). Кроме того, необходимо проведение исследования инфекционного статуса организма (наличие в крови специфических антител к инфекциям, передающимся половым путем) (см. табл.1) (20).
Табл. 1 Первичное обследование пациенток с нарушением репродуктивной функции
1. Сбор анамнеза, бимануальное и УЗ исследование;
1) Общеклиническое исследование отделяемого мочеполовых органов (мазок);
2) Бактериологический анализ отделяемого мочеполовых органов;
3) Определение антител к ВПГ, ЦМВ, токсоплазме, вирусу краснухи, хламидиям.
При обнаружении отклонений – дополнительное обследование и / или назначение соответствующего лечения. Контрольные исследования после лечения.
Включение в алгоритм обследования женщин, нуждающихся в стимуляции овуляции, маркера СА-125 (маркер рака яичников) обусловлено тем, что стимуляция овуляции сопровождается активацией продукции эстрадиола и, в связи с этим, пролиферативных процессов. Антиген СА-125 является маркером, отражающим степень выраженности процессов пролиферации (2,8).
При концентрации СА-125 > 20 МЕ/мл, измеренной до начала стимуляции, вероятность развития синдрома гиперстимуляции яичников достаточно велика.
Проблемы, возникающие при интерпретации результатов лабораторных исследований
Чаще всего эти проблемы связаны с ошибками на преаналитическом этапе обследования. Секреция многих гормонов (пролактин, АКТГ, ТТГ, кортизол) имеет суточный (циркадианный) ритм, поэтому взятие крови необходимо осуществлять в определенное время (как правило, в 8 – 9 часов утра). Если в лабораторию поступает кровь, взятая в произвольное время, то диагностическая значимость результатов анализов резко снижается. У молодых мужчин секреция гонадотропинов также имеет суточный ритм. Помимо циркадианного ритма имеется и почасовой (цирхоральный) ритм секреции многих гормонов. При однократном взятии крови возможно попадание как на максимальное, так и на минимальное содержание гормона в данной пробе. Нередко при диагностике гипо- и гипергонадотропных состояний содержание гонадотропинов в крови соответствует нижним или верхним значениям «нормы», что вызывает недоумение у клиницистов и недоверие к работе лаборатории и качеству тест-систем (3). В этих случаях во избежание диагностических ошибок необходимы повторные определения концентрации ЛГ и ФСГ или определение содержания гормонов в смешанной пробе, полученной от 2- кратного взятия крови с интервалом 30 минут.
Кроме того, получение некорректных результатов может быть вызвано нарушением правил хранения биоматериала и его транспортировки в лабораторию.
При интерпретации лабораторного обследования необходимо учитывать возможную фармакотерапию пациента, так как многие препараты прямо или косвенно влияют на эндокринную систему. Так, нейролептики, трициклические антидепрессанты снижают уровень ФСГ и увеличивают концентрацию пролактина в сыворотке. Низкий уровень тестостерона может быть связан с терапией эстрогенами, глюкокортикоидами, гипотиреозом. Гиперпродукцию тестостерона вызывают бромокриптин и рак предстательной железы. Высокий уровень эстрадиола может быть обусловлен гипертиреозом. Гиперпролактинемию часто обнаруживают при стрессе, гипотиреозе и хронических заболеваниях почек.
Определенные трудности возникают при интерпретации результатов. Лабораторный мониторинг пациента желательно осуществлять в одной и той же лаборатории для того, чтобы избежать некорректного сравнения результатов, полученных на разном оборудовании, разными методами с использованием различных реагентов. С осторожностью следует интерпретировать пограничные значения, поскольку любой лабораторный метод имеет свою вариабельность. В ряде случаев даже у здоровых людей выявляются показатели, выходящие за пределы референсных значений.
Напряженная демографическая ситуация, характерная для большинства развитых стран и во многом обусловленная увеличением числа бесплодных браков, простимулировала интенсивное развитие исследований в области репродуктивного здоровья человека. Знания закономерностей функционирования репродуктивной системы позволило не только понять механизмы нарушений генеративного процесса, но и разработать адекватные лабораторные методы их диагностики и мониторинга. Более того, во многих случаях постановка правильного диагноза невозможна без соответствующих лабораторных исследований. Современные технологии предоставляют клиницистам спектр диагностических методов, позволяющих достоверно и быстро решать проблемы выбора эффективной терапии. Затруднения, возникающие при интерпретации результатов исследований, чаще всего связаны с преаналитическим этапом анализа и с упрощенной трактовкой референсных (нормативных) пределов.
В настоящее время лабораторная служба практически на всей территории страны имеет возможности для своевременного и достоверного выявления нарушений генеративной функции и мониторинга терапии.
Что такое эндокринное бесплодие?
Эндокринное бесплодие это снег, который идет в июле, это солнце, восходящее на западе, это семена, которые засеяли несозревшими. То есть чепуха, несуразица, и полное отсутствие здравого смысла.
Организм можно сравнить с механизмом, работающим по четкой схеме. Все процессы в нем подчинены определенным законам и ритмам. Каждый процесс отлажен, за одним следует другой, и если на каком-то уровне происходит сбой, то страдает вся система.
Менструальный цикл – не исключение. Вспомните общепринятое название «месячные», это означает, что процесс регулярно повторяется из месяца в месяц, в одно и то же время, ну или примерно через одинаковые промежутки. По названию нетрудно понять, что тут действует определенный биологический цикл. Некоторые женщины так и говорят: «у меня месячные, как часы». Понятно, что речь идет о здоровых женщинах.
Итак, мы никогда не задумываемся о наших органах, когда они работают бесперебойно, мы просто этого не ощущаем. Организм дает нам возможность заниматься своими повседневными заботами, не требуя внимания. Почему? Все очень просто (хотя, если подумать, как сложно все устроено, совсем не просто, но нам не нужно в это вникать, так как организм сам знает, что делать). Так вот, просто во всех органах и системах, в их функционировании, главную роль играет регуляция процессов. Она многоуровневая, направленная от центра (структуры мозга: гипофиз, гипоталамус) к периферии (органы: матка, яичники). Состоит она из множества звеньев, а в роли проводников служат гормоны и другие биоактивные вещества. Иерархия в этой системе весьма сложная, а субординация соблюдается неукоснительно. Каждый знает свое дело и безоговорочно подчиняется раз и навсегда установленным правилам.
И как только где-то что-то дает сбой, то есть искажаются сигналы, поступающие от центра регуляции или нарушается их передача и восприятие на любом уровне, система начинает работать по принципу «испорченного телефона». Центр сигнализирует, импульсы извращаются, периферия не может распознать поступающие команды, и пытается справиться, ориентируясь на ложные сигналы или вовсе по собственному усмотрению, в свою очередь посылает повторные запросы или сигналы бедствия, центр не понимает, что происходит или вообще не получает их, усиливает или отменяет свои приказы, они опять не доходят или меняют смысл, периферия впадает в панику или наоборот, считает, что все делает верно, все повторяется, запутывается окончательно, наступает хаос. Но любая система стремится к равновесию, поэтому постепенно этот хаос и становится новым порядком с перепутанными или утраченными сигналами, с активно функционирующим (или бездействующим) центром и приспособившейся периферией.
Примерно так все и происходит при эндокринном бесплодии, а результатом наступившего нового порядка-хаоса является нарушение работы репродуктивной системы, то есть нарушение образования полноценной яйцеклетки и овуляции.
Итак, эндокринное бесплодие — это бесплодие, характеризующееся нарушением процесса овуляции. Частота этой формы бесплодия колеблется по разным данным от 4 до 40 %.
Овуляция не происходит вообще – ановуляция
Ановуляция — одна из наиболее частых причин бесплодия (нет яйцеклетки, некому оплодотворяться, нет беременности – возникает бесплодие).
Хроническая ановуляция — патологическое состояние, которое возникает из-за нарушений циклических процессов в гипоталамо-гипофизарно-яичниковой системе.
Основным признаком эндокринного бесплодия служит хроническая ановуляция на фоне тех или иных гормональных отклонений, которые могут быть как причиной нарушенного фолликулогенеза (гипопролактинемия, гиперандрогения, разнонаправленные изменения уровня гонадотропинов), так и его следствием (нарушение ритма циклической продукции эстрогенов и прогестерона). Результатом этого является многообразие клинических, биохимических, морфологических нарушений. Что в свою очередь проявляется широким спектром заболеваний: дисфункциональными маточными кровотечениями, олигоменореей, аменореей. При хронической ановуляции бесплодие часто носит смешанный характер, поскольку нарушение овуляторной функции сопровождается частым присоединением трубного, внутриматочного и цервикального факторов. Это происходит из-за негативного влияния дисбаланса женских половых гормонов на тонус маточных труб, состояние эндометрия и свойства цервикальной слизи.
Размеры яичников могут варьировать в широких пределах — от нормальных до увеличенных в несколько раз. Регулярный менструальный цикл наблюдается у 33,2 %, нерегулярный — у 23,6 % аменорея — у 43,2 % из них.
Недостаточность лютеиновой фазы менструального цикла (НЛФ).
Это нарушение функции яичников, характеризующееся сниженной функцией желтого тела яичника. Происходит овуляция, образуется желтое тело, вырабатывающее гормон второй фазы цикла – прогестерон, который подготавливает организм женщины к возможной беременности. Без определенного уровня этого гормона беременность просто не наступит, даже если произойдет оплодотворение (что, кстати, тоже маловероятно с недостатком прогестерона).
Итак, у желтого тела снижена функция, оно работает слабо. Соответственно: происходит недостаточный синтез прогестерона, что ведет к недостаточной секреторной трансформации эндометрия, изменению функции маточных труб, нарушению имплантации оплодотворенной яйцеклетки, что клинически проявляется бесплодием либо спонтанным выкидышем в I триместре беременности.
Причины НЛФ:
Основным симптомом НЛФ могут быть бесплодие или скудные кровянистые выделения за 4—5 дней до начала менструации. При постановке диагноза применяют: овуляторный тест, оценку уровня прогестерона в крови и его метаболитов в моче, биопсию эндометрия, УЗ-сканирование роста фолликулов и толщины эндометрия в динамике менструального цикла, также используется лапароскопия, произведенная после овуляции, хотя наличие овуляции еще не означает полноценную функцию желтого тела.
Лечение обычно начинают по типу заместительной терапии. Это значит, что если яичники не вырабатывают достаточное количества прогестерона, его добавляют в виде прогестеронсодержащих препаратов. Кроме того используются препараты, создающие искусственный цикл, подготавливающие пациентку к беременности, и после этого назначаются стимуляторы овуляции.
НЛФ — это патологическое состояние, ведущее к бесплодию. Поэтому лечение его довольно сложно, эффективность лечения повышаете при выяснении причины НЛФ и проведении терапии, направленной на устранении этих причин. Профилактика заключается в предупреждении тех патологических состояний, которые способствуют развитию НЛФ.
Синдром лютеинизации неовулировавшего фолликула (ЛНФ-синдром).
Что это значит. В яичнике зреет фолликул, этот процесс должен завершиться созреванием ооцита, разрывом фолликула и выходом яйцеклетки. Однако до разрыва фолликула не доходит и почти созревшая яйцеклетка остается в яичнике, то есть овуляция не происходит. Соответственно, беременность не наступает.
Частота ЛНФ-синдрома при необъяснимом бесплодии колеблется от 12-17 до 31%.
Причина не установлена. Существует точка зрения, что этот синдром может быть случайным явлением и встречается не в каждом цикле и что в его возникновении могут играть роль стресс, гиперандрогения и гиперпролактинемия.
Наиболее информативными для диагностики являются ультразвуковая эхография в течение менструального цикла и лапароскопия, производимая во вторую фазу цикла.
Специального лечения ЛНФ-синдрома не существует, так как до сих пор четко не установлены причины этой патологии. Также применяется заместительная гормонотерапия и стимуляция овуляции, что дает возможность женщинам с этими нарушениями забеременеть. Понятно, что в случае наступления беременности гормональные схемы не отменяются, так как причины заболевания никуда не исчезли, а роль репродуктивной системы взяли на себя назначенные гормоны.
Женщины с эндокринными формами бесплодия представляют группу риска неблагоприятного течения и исхода беременности и родов. Частота наступления беременности при эндокринном бесплодии и исход ее зависят от многих факторов: возраста женщины, длительности бесплодия, глубины поражения эндокринной функции, репродуктивной системы, состояния других органов и систем организма, социального положения женщины и др.
Ранее полагали, что лечение бесплодия следует проводить соматически здоровым женщинам только до 35-летнего возраста. В настоящее время, в связи с успехами в антенатальной диагностике, стимуляция овуляции возможна и в позднем репродуктивном возрасте. Однако риск для матери и ребенка высок. При наступлении беременности после стимуляции овуляции женщины нуждаются в тщательном обследовании (клиническом, УЗИ, гормональном) и наблюдении с самых ранних сроков ее, при необходимости — в условиях стационара. При доношенной беременности вопрос о тактике ведения родов также решается индивидуально с учетом возраста женщины, исхода предыдущих беременностей, продолжительности бесплодия и лечения.