метаболический генез что это такое
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
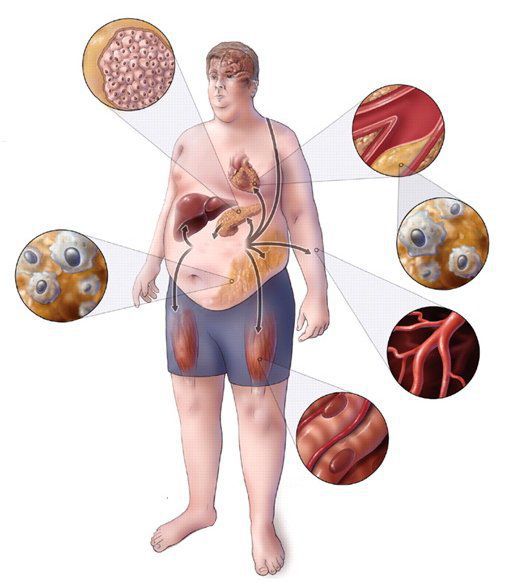
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма 1
жен. >1,2
Осложнения метаболического синдрома
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Метаболический синдром
Несмотря на то, что обнаружена некоторая генетическая подверженность к метаболическим нарушениям, нарушение образа жизни играет не малую роль в развитии метаболического синдрома. Снижение физической активности и высокоуглеводный характер питания являются главными причинами того, что заболеваемость метаболическим синдромом возрастает. Метаболическим синдромом страдает около 25% населения западных стран. Это заболевание чаще встречается у мужчин, у женщин его частота возрастает в менопаузальном периоде.
Причины заболевания
При метаболическом синдроме гормональные нарушения способствуют отложению жира в области живота, выше пояса. Возникает абдоминальный тип ожирения. По результатам последних исследований сама жировая ткань способствует развитию инсулинорезистентности. Однако не все составляющие метаболического синдрома можно четко связать и объяснить инсулинорезистентностью, не изучены все возможные причины и механизмы развития инсулинорезистентности при абдоминальном ожирении.
Симптомы метаболического синдрома
Нарушения, объединенные рамками метаболического синдрома, длительное время протекают бессимптомно, нередко начинают формироваться в подростковом и юношеском возрасте, задолго до клинической манифестации в виде сахарного диабета, артериальной гипертонии и атеросклеротических поражений сосудов. Наиболее ранними проявлениями метаболического синдрома являются дислипидемия и артериальная гипертензия. Разумеется, не все компоненты метаболического синдрома встречаются одновременно.
Возможные жалобы: на повышенную утомляемость, апатию, одышку, повышенный аппетит, жажду, учащенное мочеиспускание, головную боль, сухость кожи, потливость.
Диагностика
Диагностикой метаболического синдрома занимается врач терапевт или эндокринолог. На приеме врач проведет тщательный осмотр с измерением веса и окружности талии, измерением артериального давления, соберет анамнез заболевания. Далее назначают ряд лабораторных анализов: развернутый биохимический анализ крови с определением показателей углеводного и липидного обмена, определение инсулина, половых гормонов и в крови и др.
Выделяют заболевания, которые могут сопутствовать метаболическому синдрому и являться его осложнениями.
Если вы обнаружили у себя симптомы метаболического синдрома или вы страдаете одним из перечисленных заболеваний, следует пройти обследование для исключения метаболического синдрома и при необходимости пройти лечение. Ранняя диагностика метаболического синдрома это в первую очередь профилактика, предупреждение или отсрочка манифестации сахарного диабета II типа и атеросклеротических сосудистых заболеваний.
Лечение метаболического синдрома
Чем поможет врач
Лечение назначают в зависимости от степени обменных нарушений и тех заболеваний, которые выявлены у пациента. Лечение направлено на коррекцию углеводного обмена, снижение массы тела, купирование артериальной гипертонии и симптомов сахарного диабета.
Что можете сделать вы
При лечении метаболического синдрома необыкновенно важно в точности выполнять все назначения врача. Только в таком случае коррекция метаболизма будет адекватной.
Мероприятия, направленные на уменьшение массы абдоминально-висцерального жира – это второе не менее важное условие терапии. Мероприятия можно разделить на рациональное питание и умеренные физические нагрузки. Рацион составляется с учетом массы тела, возраста, пола, уровня физической активности и пищевых пристрастий больных. Ограничивается потребление жира и быстроусвояемых углеводов. В рацион вводят большое количества пищевых волокон. Снижение массы тела приводит к повышению чувствительности к инсулину, уменьшению системной гиперинсулинемии, нормализации показателей липидного и углеводного обменов, снижению артериального давления.
Метаболический синдром: симптомы и диагностика нарушений обмена веществ
Метаболический синдром (МС) – это комплекс патологий, которые увеличивают риск возникновения сердечно-сосудистых заболеваний, инсульта и инфаркта.
Симптомы метаболического синдрома
По сути, метаболический синдром не является самостоятельным заболеванием. Это группа симптомов, которые часто встречаются вместе и увеличивают риск других – еще более тяжелых – нарушений.
Тревожные тенденции
Еще недавно метаболическим синдромом страдали преимущественно пожилые люди (старше 60 лет). Картина существенно изменилась за последние 20 лет. Динамика показала, что эта проблема молодеет и становится актуальной для более юного населения. В ряде стран доля взрослого населения, страдающая от этих симптомов, достигает 25%.
У метаболического синдрома есть еще одно название – «синдром нового мира». Дело в том, что преимущественно от ожирения и связанных с ним патологий страдают люди, ведущие малоподвижный образ жизни (а это касается преобладающего числа жителей больших городов), употребляющие большое количество быстрых углеводов и трансжиров. В результате во всем мире наблюдается всплеск сердечно-сосудистых заболеваний и диабета.
Метаболический синдром затрагивает как развитые страны (где высокотехнологичное производство избавило население от необходимости много двигаться), так и развивающиеся (большому проценту населения которых приходится экономить на продуктах питания и потреблять больше быстрых углеводов – макарон, хлеба, картофеля, кукурузы).
Есть и другая тенденция последних лет. От метаболического синдрома стали страдать женщины репродуктивного возраста. С чем это связано, до конца неясно. Предположительно, могут негативно влиять оральные контрацептивы.
Только представьте: за последние 20 лет число людей с метаболическим синдромом в мире выросло более чем на 100 млн – то есть на треть.
Особенно остро стоит проблема детского ожирения, а с ним и детского МС. Ученые связывают рост детского ожирения с частым отказом от грудного вскармливания. Грудное вскармливание исключает раннее введение прикорма, которое может привести к нездоровому увеличению веса. Потребление белка и общего количества энергии выше у детей, вскармливаемых смесями, что приводит к увеличению массы тела у младенцев. Также кормление смесью несколько увеличивает уровень инсулина, что в свою очередь способствует отложению жира и раннему развитию жировых клеток (адипоцитов).
Таким образом, быстрая прибавка в весе в младенческом возрасте связана с ожирением в детстве. Грудное вскармливание может помочь «запрограммировать» человека на поддержание здорового веса во взрослом возрасте.
В чем причины?
Метаболический синдром имеет наследственную предрасположенность, которая, однако, в большей степени тоже объясняется внешними факторами. Люди, выросшие в одной семье, с большей вероятностью будут иметь схожие пищевые привычки и одинаковое отношение к спорту. Если на родительском столе бывает огромное количество быстрых углеводов и жиров и мало – овощей, зелени и фруктов, у ребенка с детства закладываются нездоровые отношения с едой. Так же и со спортом: ребенок с большей вероятностью будет активным, если у него активные родители.
Факторы риска
Осложнения
Диагностика метаболического синдрома
Диагностика МС состоит из визуального осмотра у врача и лабораторных и инструментальных исследований. В первую очередь врач оценивает абдоминальное ожирение. Но одного лишнего веса для постановки диагноза недостаточно. Оцениваются и другие симптомы и результаты анализов. Также важно обнаружить причину ожирения. Лишний вес может быть следствием эндокринных нарушений, гормональных сбоев или иных патологий.
Другой важный критерий при постановке диагноза – артериальное давление. При метаболическом синдроме оно обычно повышено.
ЭКГ – требуется, чтобы проверить работу сердца и вовремя обнаружить патологии, если заболевание уже запущенно.
Ангиография. Сложное исследование, которое позволяет оценить состояние сосудов. Проводится только по назначению врача.
Диагностика метаболического синдрома – непростая комплексная задача, которая осложняется разнообразием форм заболевания, его причинами и способами коррекции. Также это состояние опасно тем, что долгие годы человек не ощущает себя больным. Самочувствие начинает страдать, когда появляются значительные отклонения в работе организма и развиваются осложнения. Ни один человек не может ощутить повышенный уровень глюкозы в крови или нарушение обмена холестерина. О себе дают знать только уже очень серьезные проблемы, вызванные этими нарушениями, – например, гнойное воспаление пальцев ног или сердечный приступ.
Международная классификация болезней не выделяет метаболический синдром как отдельное заболевание, это целый комплекс заболеваний.
Ни один диагноз нельзя поставить самостоятельно, но любое отклонение в результатах исследований – повод не откладывать поход к врачу.
Лечение
В более запущенных формах может потребоваться применение препаратов, снижающих инсулинорезистентность, и лечащих артериальную гипертонию.
Диагностика и лечение метаболических кардиомиопатий, возникающих при нарушениях обмена жирных кислот, у детей
Рассмотрены причины метаболических кардиомиопатий (КМП), возникающих на фоне нарушений обмена жирных кислот. Выделены экстракардиальные и кардиальные критерии диагностики. Ранняя диагностика позволяет своевременно начать специфическое лечение, направленно
Are examined the reasons for metabolic cardiomyopathy (KMP), disturbances of the exchange of fatty acids appearing against the background. The extracardial and cardiac criteria of diagnostics are listed. Early diagnostics makes it possible to begin the specific treatment in proper time, directed toward the correction of metabolic disorders.
Кардиомиопатии (КМП) — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. В большинстве случаев диагностика КМП основывается на клинических симптомах и данных функционального обследования, в первую очередь эхокардиографии [1–3]. При этом истинная этиология КМП не всегда устанавливается. По данным наиболее крупного регистра КМП у детей США и Канады среди группы, в которой причина КМП была установлена, в 29,1% был диагностирован миокардит, в 24,2% — семейная изолированная КМП, в 22,2% — нейромышечные заболевания, в 15,4% — врожденные нарушения метаболизма и в 8,8% — различные генетические синдромы [3–6].
Причинами метаболических КМП являются врожденные нарушения обмена веществ или нарушения функции органелл клетки. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП. По данным педиатрического регистра при гипертрофических КМП в 20% случаев выявлены нарушения транспорта карнитина или дефекты окисления жирных кислот, нарушения окислительного фосфорилирования [7]. При дилатационных КМП дефекты транспорта карнитина/нарушения оксидации жирных кислот встречаются в 40% [8]. Наследственные дефекты обмена жирных кислот являются причиной не менее 5% случаев внезапной детской смерти [9].
Нарушения метаболизма жирных кислот могут возникать вследствие дефицита карнитина, нарушения транспорта карнитина при недостаточности ферментов, обеспечивающих перенос соединений карнитина, а также при дефектах оксидации жирных кислот [10].
Дефицит карнитина можно определить как дефицит внутриклеточного содержания карнитина, при котором концентрация карнитина в плазме менее 20 мкмоль/л, а содержание карнитина в тканях менее 20% от нормы. В зависимости от причины дефицита карнитина выделяют первичный дефицит карнитина, возникающий при генетически детерминированных дефектах метаболизма карнитина, и вторичный дефицит карнитина, связанный с нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ, дефектами в цепи дыхательных ферментов митохондрий, рядом соматических заболеваний и патологических состояний [11].
Первичный дефицит карнитина может проявляться в двух формах: системной [13, 14] и мышечной [11, 16]. Системный дефицит карнитина обусловлен мутацией гена SLC22A5, локализованного на длинном плече 5-й хромосомы (5q319), продуктом которого является белок, переносящий карнитин (OCTN2). Результатом этой мутации является дефицит карнитина в тканях. Заболевание наследуется по аутосомно-рецессивному типу [13–14]. При гомозиготной форме сроки манифестации заболевания варьируют от 1 месяца до 7 лет, в среднем 2 года. При гетерозиготной форме манифестация заболевания возникает в подростковом возрасте [14–16].
При раннем дебюте заболевания первыми признаками являются отказ от кормления, раздражительность, низкая прибавка в весе, отставание в физическом и психомоторном развитии. Характерным признаком является гипокетотическая гипогликемическая энцефалопатия (вялость, сонливость, повторная рвота), имеющая приступообразное течение. Во время гипогликемического криза возникают общая слабость, тахикардия, церебральная дисфункция (повышенная возбудимость, раздражительность). В дальнейшем развиваются гепатомегалия, стеатоз печени, нарушения желудочно-кишечного тракта (боли в животе, диарея), скелетная миопатия (мышечная слабость, гипотония), синдром Рейе. Как правило, дети часто болеют интеркуррентными заболеваниями: инфекционные заболевания верхних дыхательных путей и острый гастроэнтерит. У ряда пациентов возникает гипохромная анемия. Тяжесть заболевания варьирует от легких до крайне тяжелых вариантов. При легком течении отставание в физическом и психомоторном развитии может быть единственным проявлением заболевания [14–16].
На ЭКГ определяется высокий вольтаж комплексов QRS за счет компенсаторной гипертрофии субэпикардиальных слоев миокарда. Обязательным признаком являются смещение сегмента ST ниже изолинии в стандартных и левых грудных отведениях, отрицательный зубец Т в этих отведениях, однако могут быть «гигантские» зубцы Т, превышающие по величине зубец R желудочкового комплекса (специфичный признак карнитиновой КМП); признаки гипертрофии левого желудочка, левого предсердия. Рентгенологически определяется кардиомегалия преимущественно за счет увеличения левого желудочка и левого предсердия. Данные эхокардиографии (ЭХО-КГ) выявляют резкое снижение фракции выброса, значительную дилатацию левого желудочка и левого предсердия, гипокинезию межжелудочковой перегородки, смещение митрального клапана к задней стенке левого желудочка, уплотнение эхосигнала от эндокарда.
У гетерозиготных носителей мутации гена SLC22 A5 карнитиновая недостаточность может проявиться в более старшем возрасте в виде гипертрофической КМП [16].
Лабораторные признаки системного дефицита карнитина: низкий уровень карнитина в тканях (печени, мышцах); приступы гипогликемии, не сопровождающиеся кетозом; повышение активности трансаминаз, уровня аммиака в крови; гипохромная анемия. Уровень свободного карнитина в крови обычно резко снижен. При исследовании методом тандемной масс-спектрометрии содержание свободного карнитина (С0) 70–100. В фибробластах снижена активность карнитинпальмитоилтрансферазы I (около 10% от нормы), окисление пальмитата составляет около 5% от нормы [23, 24].
Дефицит карнитинпальмитоилтрасферазы II. Наследование аутосомно-рецессивное, вызывается мутациями в гене карнитинпальмитоилтрансферазы II. Заболевание может протекать в трех формах: неонатальной (летальной), детской (инфантильной) и поздней (форма взрослых).
Неонатальная (летальная) форма характеризуется манифестацией с первых дней жизни, прогрессирующим течением, очень тяжелым состоянием детей и плохим прогнозом. Заболевание проявляется полиорганным поражением. У новорожденных развиваются гипотермия, летаргия, судороги, гипотония, гиперрефлексия и гепатомегалия, почечная недостаточность. Характерны дисморфии лица, контрактуры коленей и локтей, длинные сужающиеся пальцы рук и ног, гепатомегалия (макровезикулярный стеатоз), поликистоз почек, дисплазия почечной паренхимы, гидронефроз, тубулярные расстройства (проксимальный и дистальный канальциевый ацидоз), грубые изменения ЦНС (вентрикуломегалия, кальцификаты, дисплазия мозолистого тела, полимикрогирии, кисты паравентрикулярные и базальных ядер) [25].
Поражение сердца проявляется с рождения в виде гипертрофии левого желудочка или бивентрикулярной гипертрофии, реже возможно развитие кардиомегалии с низкой сократительной способностью сердца. В большинстве случаев регистрируются нарушения ритма сердца, возникновение желудочковой тахиакардии часто является причиной внезапной смерти [25].
Лабораторные признаки: некетотическая гипогликемия, увеличение в сыворотке, моче и тканях длинноцепочечных ацилкарнитинов (С16, С18), снижение плазменного общего и свободного карнитина, длинноцепочечная дикарбоновая ацидурия, гипераммониемия, увеличение общего билирубина, трансаминаз печени, кретинфосфокиназы, высокое содержание дикарбоксильных кислот в моче. Заболевание верифицируется выраженным снижением активности (менее 10% от нормы) карнитинпалмитоилтрансферазы II в большинстве тканей, отсутствием белка CPT II [24, 25].
При морфологическом исследовании обнаруживается накопление липидов в ткани печени, почек, скелетных мышц, легких, надпочечников и др.
Инфантильная форма манифестирует с 3 месяцев, провоцируется лихорадочными состояниями и нарушениями питания. Характерны гепатомегалия, миопатический синдром, судороги. Поражение сердца — по типу дилатационной КМП. Миопатическая форма (поздняя) протекает благоприятно, может дебютировать как в детском возрасте, так и у взрослых. Основные проявления: боли в мышцах, обычно сопровождающиеся миоглобинурией. Характерна высокая активность креатинфосфокиназы в крови, при голодании может возникать умеренный кетоз. Изменения со стороны сердца минимальны [24].
Дефицит карнитинацилкарнитинтранслоказы — редкое аутосомно-рецессивное заболевание, приводящее к нарушению утилизации длинноцепочечных жирных кислот [24]. Выделяют две формы заболевания: неонатальная и инфальтильная. Неонатальная форма характеризуется высокой летальностью вследствие сердечно-легочной недостаточности. Основные проявления: нарушение общего состояния и психомоторного развития, расстройства дыхания, изменения со стороны ЦНС в виде мышечной слабости, судорог, возможно развитие комы на фоне голодания, гепатомегалия с нарушением функции печени.
Поражение сердца встречается чаще по типу дилатационной КМП, характерно снижение систолической функции, возможны нарушения ритма: брадикардия, атриовентрикулярная блокада, желудочковая экстрасистолия, тахикардия. На ЭКГ — признаки гипертрофии левого желудочка. У новорожденных описаны случаи внезапной смерти вследствие апноэ, кардиореспираторного ареста. Если заболевание возникает в более позднем возрасте, то КМП протекает на фоне мышечной слабости и энцефалопатии [10, 26].
Отклонения в лабораторных показателях включают гипогликемию при отсутствии кетоза, увеличение в крови уровня аммиака, иногда калия и мочевой кислоты, высокую активность креатинфосфокиназы, трансаминаз, дикарбоксильную и гидроксидикарбоксильную ацидурию, а также увеличение уровня ацилкарнитинов в крови (С16–С18) в сочетании с низким уровень свободного карнитина (С0). Патология верифицируется низкой активностью карнитин-ацилкарнитин-транслоказы.
Дефекты окисления жирных кислот. Карнитин-ацилтрансферазы осуществляют перенос карнитина к ацильным компонентам коротких, средних и длинных цепей. Ацил-КоА-дегидрогеназы длинных цепей обеспечивают внутримитохондриальную бета-оксидацию жирных кислот с длинными карбоновыми цепями. Ацил-КоА-дегидрогеназы средних цепей регулируют внутримитохондриальное окисление жирных кислот средней длины карбоновых цепей. Ацил-КоА-дегидрогеназы коротких цепей обуславливают внутримитохондриальное окисление жирных кислот с короткой длиной карбоновых цепей, являются буфером ацильных групп, регулируя их поступление в цикл Кребса [27–29].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью возникает в результате мутации гена дегидрогеназы очень длинной цепи ацил-КоА, наследование аутосомно-рецессивное. Мультисистемная патология: поражаются печень (гепатомегалия, стеатоз печени, гепатоцеллюлярный некроз), мышцы. Симптомами поражения мышц являются гипотония, мышечная слабость, связанная с голоданием или инфекцией, боль в мышцах при физической нагрузке, ригидность мышц, рабдомиолиз при физической нагрузке. Миопатические эпизоды вызваны физическими упражнениями, голоданием, инфекцией, воздействием низких температур. По срокам появления первых признаков выделяют 3 формы заболевания: неонатальную, детскую и позднюю [27–29].
Неонатальная форма характеризуется ранней манифестацией, в течение первых дней жизни, с развитием КМП и ранней смерти. Поражение сердца по типу гипертрофической КМП в сочетании со сниженной контрактильной способностью, часто возникают жизнеугрожающие нарушения сердечного ритма. Во время гипогликемической комы возможно развитие асистолии и внезапной смерти [30].
При детской форме (около 40% больных) начальные симптомы обычно появляются на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, манифестирует в подростковом возрасте, клинически проявляется болями в мышцах, как правило, сердце не вовлекается в патологический процесс.
Лабораторные признаки: некетоновая гипогликемия, дикарбоновая ацидурия, повышение концентрации лактата в крови. Диагностический маркер — снижение свободного карнитина при увеличении ацилкарнитинов (С14:1 и С14, С16OH), повышение активности креатинфосфокиназы, ацидурия дикарбоксильных кислот с длинной углеродной цепью (С14–С18) [23]. Специфична низкая активность дегидрогеназы очень длинной цепи ацил-КоА в фибробластах или мононуклеарных лейкоцитах.
Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи возникает в результате мутации гена средней цепи ацил-КоА-дегидрогеназы, наследования аутосомно-рецессивное. Наиболее распространенное нарушение окисления жирных кислот [27, 29].
Характер поражения сердца аналогичен таковому при карнитиновой КМП. Часто возникают тяжелые нарушения сердечного ритма, остановка синусового узла, желудочковая тахикардия (по типу приступов пируэтной тахикардии (torsades de pointes)) [10, 30]. Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи является в 1–3% причиной внезапной смерти у детей раннего возраста [10].
Лабораторные признаки: гипогликемия, метаболический ацидоз, дикарбоновая ацидурия средних цепей, ацилглицинурия, низкое содержание плазменного карнитина. Может отмечаться умеренная кетонурия. В крови повышен уровень среднецепочечных ацилкарнитинов (С6–С10). В моче определяется специфическая органическая ацидурия с преобладанием среднецепочечных дикарбоновых кислот, глициновых конъюгатов [27–28].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с короткой длиной углеродной цепи. Возникает в результате мутации гена короткой цепи ацил-КоА-дегидрогеназы, наследование аутосомно-рецессивное.
Генерализованная форма может проявиться у новорожденных или детей первого года жизни, течение неблагоприятное, возможен летальный исход. Характерны судороги, задержка развития, микроцефалия, повторные приступы рвоты, прогрессирующая мышечная слабость, вялость, сонливость. Поражение сердца характеризуются дилатационной КМП, осложненной тяжелой СН. При мышечной форме первые признаки болезни появляются в старшем возрасте. В клинической картине на первый план выступают миопатические расстройства, низкая толерантность к физической нагрузке. Поражение сердца по типу дилатационной КМП протекает субклинически и выявляется обычно у подростков [29, 30].
Множественный дефицит ацил-КоА-дегидрогеназ описан как глутаровая ацидурия 2-го типа, наследование аутосомно-рецессивное. Патология обусловлена дефектом электронно-транспортного флавопротеина и дефицитом нескольких флавопротеин-содержащих дегидрогеназ, что значительно снижает эффективность митохондриального бета-окисления. Нарушены функции изовалерил-, изобутирил-, метилбутирил-, глутарил-КоА-дегидрогеназ, участвующих в метаболизме ряда аминокислот и холина.
Выделяют несколько клинических форм: неонатальную форму с врожденными аномалиями (летальную), неонатальную форму без врожденных аномалий, позднюю форму.
Метаболические проявления включают тяжелый метаболический ацидоз, гипогликемию, гипераммониемию. Кетоз выражен умеренно или отсутствует, гиперлактат- и гиперпируватемия с увеличением их соотношения до 20 и выше (норма
И. В. Леонтьева, доктор медицинских наук, профессор
Ю. М. Белозеров, доктор медицинских наук, профессор
ФГБУ НИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва