мезенхимальные стромальные клетки что это
Мезенхимальные стромальные клетки что это
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Развивающимся направлением клеточной медицины является использование уникальных свойств прогениторных клеток, обладающих высокой биологической активностью и потенциалом дифференцировки. Мультипотентные мезенхимные стромальные клетки (ММСК) являются полипотентными клетками, обладающими рядом важных для клинического применения свойств. Применение ММСК, культивированных «ex vivo», открывает вопрос об оценке качества и безопасности культуры для клинического применения. Целью настоящего обзора являлась разработка программы культивирования и исследования значимых свойств человеческих ММСК для клинического применения. Приведена характеристика этапов оценки качества и безопасности ММСК, включая культивирование клеток «ex vivo», оценку иммунофенотипа, ростовых, иммуномодулирующих, регенеративных и прогениторных свойств, оценку генетической и микробиологической безопасности. Проведена оценка «in vitro» тестов для определения качества и безопасности ММСК. Подчёркивается, что выраженность свойств каждого отдельного образца различна и зависит от источника и условий культивирования клеток.
Остаётся открытым вопрос об оценке качества и безопасности ММСК, культивируемых для клинического применения. Очевидно, что каждый образец ММСК, который будет применён для лечения, должен быть оценен с позиции наличия у клеток необходимых в данной клинической ситуации полезных биологических свойств и безопасности для пациента.
Целью настоящего обзора литературы являлось определение основных этапов исследований индивидуальных значимых свойств образцов человеческих ММСК в процессе культивирования для клинического применения.
Источники получения ММСК
Очевидно, что эксплантация источников ММСК взрослого организма (костный мозг, жировая ткань) требуют инвазивного вмешательства, чреватого осложнениями. Неонатальные же источники ММСК могут быть получены без какого-либо значимого вмешательства в процесс родов.
Таким образом, контроль качества материала для экспансии ММСК должен включать комплекс медицинских, этических и правовых мероприятий, связанных с забором материала для экспансии, особенно связанного с инвазивными процедурами. Важен возраст донора в случае культивирования ММСК из взрослых тканей, в случае забора плацентарной ткани требуется оценка доли клеток фетального происхождения и доли материнских ММСК.
Условия культивирования ММСК
Таким образом, различные условия культивирования ММСК существенно влияют на их свойства. Следовательно, изменяя условия культивирования образцов ММСК можно добиться улучшения их клинически значимых характеристик.
Оценка «чистоты» полученной культуры ММСК
При изучении свойств ММСК было обнаружено большое количество поверхностных кластеров дифференцировки, экспрессируемых клетками. Если взять все описанные для ММСК маркеры, использующиеся для идентификации или селекции ММСК, то их число превысит несколько десятков. Данные по экспрессии поверхностных маркеров ММСК представлены в таблице.
Оценка способности ММСК к дифференцировке
Таким образом, оценка дифференцировочного потенциала ММСК проводится в двух направлениях:
1) качественное, цель которого подтвердить способность данной культуры к дифференцировке;
2) количественное, с целью оценить клиническую ценность данного конкретного образца.
Определение пролиферативного потенциала ММСК и старения клеток в культуре
Взаимодействие ММСК с другими клетками
Важнейшим свойством ММСК, которое является основой большинства случаев их клинического применения, является способность взаимодействовать с другими клетками как in vitro, так и in vivo. Взаимодействие с другими клетками реализуется как за счет непосредственных клеточных контактов, так и посредством продукции паракринных факторов. Виды взаимодействия ММСК с другими клетками организма, определяющие клинический эффект, можно подразделить на:
– взаимодействие ММСК с клетками иммунной системы (иммуномодулирующий и противовоспалительный эффект);
– взаимодействие с клетками повреждённых тканей (трофический и антиапоптотический эффект);
– стимуляция ангиогенеза (улучшение васкуляризации тканей);
– формирование стромы для гемопоэтических предшественников (обеспечение гемопоэза).
Оценка генетической стабильности ММСК
Исходя из данных литературы, можно сделать вывод, что оценка генетической стабильности ММСК является неотъемлемой частью системы контроля качества культивируемых ex vivo клеток. Однако литературные источники говорят, что большинство нарушений, выявляемых в трансформированных ММСК, проявляются на генном уровне и лишь в ходе опухолевой прогрессии начинают проявляться грубые поломки генома.
Следует добавить, что исследования генетической стабильности ММСК важны не только для реципиента ММСК, но и для донора. Вероятно, наличие генетических поломок в культуре ММСК является неблагоприятным прогностическим признаком в плане возможного возникновения онкологических заболеваний у донора в будущем.
Микробиологическая безопасность культуры ММСК
Не нуждается в комментариях то, что ММСК, полученные для клинического применения, должны быть безопасны в плане отсутствия контаминации микрофлорой. Бактериологическая безопасность образцов ММСК достигается путём соблюдения ряда правил и норм асептики и антисептики, касающихся всего процесса экспансии ММСК – от забора материала до выдачи готовой к применению культуры. Более интересным и неисследованным является вопрос о вирусологической безопасности ММСК, так как возможен перенос вирусов как вне клеток вследствие загрязнения материала, полученного от донора – носителя вируса, так и внутри самих ММСК при наличии тропизма вируса к клеткам.
Из приведённых данных следует вывод, что вирусологическое исследование образца ММСК должно включать как обследование самого донора, так и тестирование культуры ММСК на наличие в ней генома вирусов, тропных к ММСК.
Заключение
Таким образом, на основании анализа данных литературы можно привести основные этапы исследования клинически значимых свойств образцов ММСК. Контроль качества ММСК можно разделить на:
1. Общий контроль качества – безопасность полученных клеток и их общебиологических свойств, включающий:
а) оценку микробиологической безопасности:
– бактериологическое исследование среды, в которой культивировались клетки;
– серологическое исследование донорской сыворотки на антитела и антигены ВИЧ, гемотрансмиссивных гепатитов, парвовируса, цитомегаловируса, ВПГ1 и герпеса 6 типа;
– ПЦР исследование МСК с целью выявления вирусов: парвовирус, цитомегаловирус, ВПГ 1, герпес 6 типа;
б) иммунофенотипирование полученных ММСК – иммунологический минимум для подтверждения принадлежности к ММСК: определение экспрессии CD105, CD73 и CD90 в сочетании с отсутствием экспрессии CD45, CD34; CD14 или CD11b; CD79α или CD19 и HLA-DR;
в) оценка пролиферативных свойств и темпа старения ММСК в культуре – определение кумулятивного времени удвоения популяции, определение относительного количества КОЕ-Ф, МТТ-тест, качественная или количественная оценка активности ассоциированной со старением β-галактозидазы, оценка длины теломер;
г) качественная оценка способности к дифференцировке в остеогенном, хондрогенном и адипогенном направлении – с целью подтверждения принадлежности культуры к ММСК – культивирование в соответствующих дифференцировочных средах.
2. Специальный контроль качества – набор лабораторных тестов (в зависимости от поставленной конкретной клинической задачи):
а) оценка генетической стабильности включает:
– кариотипирование, выявление транслокаций и делеций участков 12, 20 и других хромосом, сравнительная геномная гибридизация (CGH);
– определение экспрессии генов p14, c-Myc, p21, p53, CDK-1, CDK-2, CDK-6, c-Myc, HGMA2, INK4A и RB;
– определение длины теломер и активности теломеразы;
б) количественная оценка способности к остеогенной и хондрогенной дифференцировке – с целью оценки активности образца ММСК в перспективе дальнейшего приживления in vivo и замещения дефектов целевых тканей. Остеогенная дифференцировка может быть определена по экспрессии генов CDC20, HIST2H2AA3, Runx2, ИЛ11, количественной оценке уровня щелочной фосфатазы, глюкозоаминогликанов. Хондрогенная дифференцировка может быть оценена по экспрессии генов агрекана Aggrecan, Sox9, Col2a1, можно дополнительно определять уровень miR-140;
в) оценка иммуномодулирующих свойств ММСК – способность подавлять в культуре пролиферацию NK клеток и Т-лимфоцитов, уровень экспрессии цитокинов TGFβ, ИЛ6, ИЛ10, ИЛ12, TNF-α, простагландина Е2, индоламин 2,3-дезоксигеназы, HGF;
г) оценка поддержки ГСК – определение уровня цитокинов SDF1, ГМ-КСФ, Г-КСФ, SCF, ИЛ6, EPO;
д) оценка паракринной функции – определение уровня цитокинов b-NGF, NT-3, NT-4, BDNF нейрорегулин-1, IGF-1, VEGF, М-КСФ, ИЛ6, ИЛ11, ИЛ15, SCF, SDF-1,sICAM-1, TGF-b, HGF, FGFIGF, имеющих помимо всего прочего нейротрофическое, ангиогенное и противоапоптотическое действие;
е) проведение HLA-типирования в случае, если клинический эффект предполагает приживление и дифференцировку аллогенных ММСК.
Указанный перечень, сформулированный нами на основе анализа значительного объема экспериментально-клинических данных, является обобщенным – для каждой конкретной ситуации, в зависимости от цели клинического применения культуры ММСК из приведенного списка должны быть выполнены отдельные, наиболее значимые пункты.
Экзосомы: научная альтернатива сказочным молодильным яблокам
Визуализация секреции экзосом.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Над «эликсиром красоты и молодости» трудились все: от древних греков до алхимиков, от ведуний до врачей современности. И пусть все еще не существует «эликсира молодости» или «таблетки от старости» — на сегодняшний день уже есть ряд открытий и исследований, позволяющих обновить клетки различных тканей. В данном обзоре внимание будет сконцентрировано на коже и механизмах ее искусственной регенерации.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Кожа молодая и старая
Для начала разберемся, как устроена кожа. Верхний слой — эпидермис — защищает ее от механических повреждений. Под ним расположена дерма, или собственно кожа. В ней залегают протоки желез, нервные окончания, волосяные луковицы, мышечные волокна.
Наконец, «фундаментом» кожи является внеклеточный матрикс (ВКМ). Его основные элементы: гиалуроновая кислота, эластические и коллагеновые волокна — поддерживают структуру кожи, обеспечивая ей здоровый и подтянутый вид. Кроме того, в матриксе содержатся фибробласты — специальные клетки, которые отвечают за его регенерацию — и металлопротеиназы — ферменты, разрушающие вышедшие из строя элементы матрикса. Больше узнать о ВКМ можно в статье «Что такое внеклеточный матрикс и почему его все изучают» [1].
Чем же старая кожа отличается от молодой? Один из самых очевидных признаков — морщины. Они появляются как раз из-за изменений в матриксе: старые коллагеновые волокна начинают разрушаться металлопротеиназами быстрее, чем фибробласты синтезируют новые.
Причина такого сбоя в том, что с возрастом изменяется количество и активность фибробластов. Из-за этого они синтезируют новые волокна коллагена медленнее и в меньших количествах. В то же время увеличивается количество фермента металлопротеиназы, разрушающей уже существующие волокна. В итоге кожа становится морщинистой и дряблой, а ресурсов на восстановление у нее все меньше и меньше. Доказано, что возрастные снижения активности деления и коллагенового синтеза фибробластов связаны с понижением факторов (особых белков-активаторов), связанных с их ростом и развитием, например, с PDGF (связывается с рецепторами фибробластов и повышает их способность к делению) и TGF-beta (участвует в матричном биосинтезе фибробластов).
Поврежденная кожа
Однако на активность фибробластов, целостность коллагеновых нитей и количество металопротеиназы влияет не только возраст. Кожа может сильно повреждаться в результате механического воздействия и внешних факторов, таких как грязный воздух, курение, несбалансированное питание или УФ-излучение. Для последнего даже введен термин «фотостарение», означающий ухудшение состояния кожи в результате избытка попадающего на нее ультрафиолета [2], [3]. Признаками фотостарения является гиперпигментация, сухость, грубость и тусклый цвет кожи. Более того, результатом фотостарения может стать рак кожи.
Однако полная регенерация практически невозможна, и в результате на месте повреждения остается шрам.
Относительно недавно перед учеными открылся новый способ омоложения кожи и улучшения ее качества. Он основан на терапевтических свойствах экзосом, секретируемых стволовыми клетками: мезенхимальными стромальными клетками в случае механических повреждений кожи и человеческими индуцированными плюрипотентными клетками — в случае проведения клеточного омоложения. Стоит признаться, что на данном этапе этот способ является далеко не самым эффективным и требует множества дополнительных исследований, однако его потенциал неоспорим.
Экзосомы: что это такое?
Экзосомы — «бутылочная почта» организма. Это мелкие мембранные пузырьки, которые выделяются в межклеточное пространство клетками самых разных тканей и органов и с кровью разносятся по организму. Внутри пузырьков находится «коктейль» из белков, ДНК, разных видов РНК и липидов [5]. Компоненты этого коктейля могут участвовать в межклеточной коммуникации, иммунном ответе и многих других процессах. В статьях «Биомолекулы» «Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт» и «Экзосома — механизм координации и взаимопомощи клеток организма» вы можете узнать больше об экзосомах и их роли в межклеточной коммуникации [6], [7].
Из всего коктейля наибольший интерес представляют микроРНК, так как, видимо, именно ими обусловлен терапевтический эффект экзосом.
Как уже было сказано, экзосомы, использующиеся для терапии кожи, выделяются из мезенхимальных стромальных клеток и человеческих индуцированных плюрипотентных клеток. Рассмотрим свойства обоих типов клеток и их экзосом.
Мезенхимальные стромальные клетки и их экзосомы в лечении кожи
Мезенхимальные стромальные клетки (МСК) — это стволовые клетки, которые находятся в соединительной ткани. Из них получаются остеобласты, хондроциты и адипоциты.
Кроме того, эти клетки обладают мощным потенциалом для восстановления кожи. Доказано, что MСК оказывают положительный эффект на раны и шрамы: после терапии следы от повреждений почти пропадают, а раны заживают в разы быстрее [8].
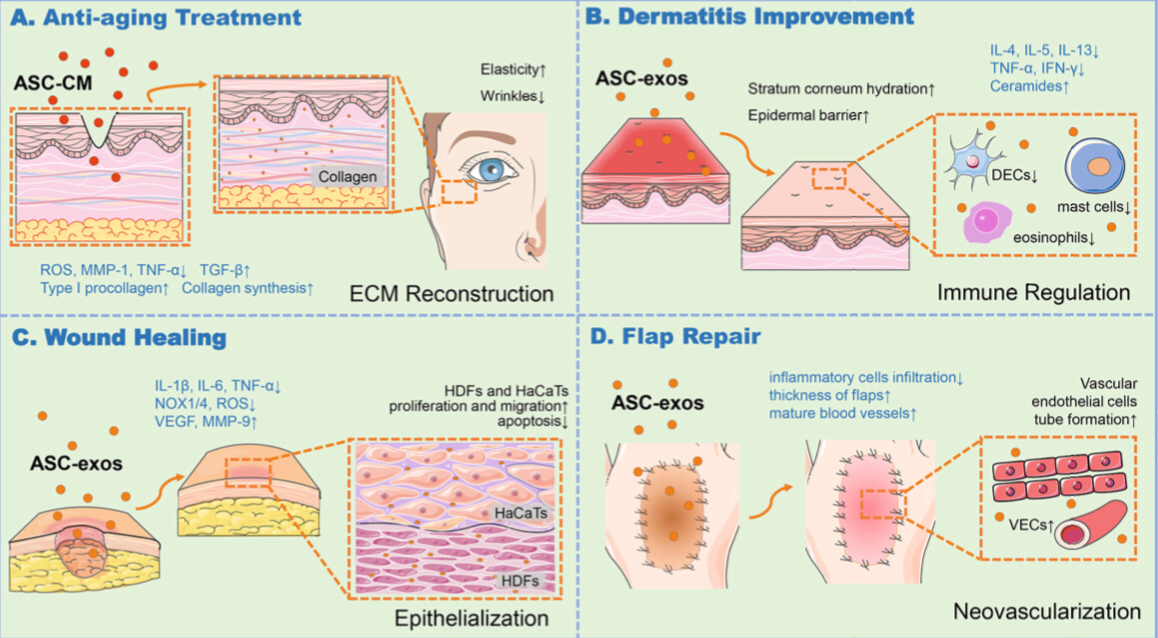
В силу своей способности к неограниченному делению (как и другие стволовые клетки), мезенхимальные клетки стали привлекательным вариантом для использования в регенеративной медицине. На сегодня эти клетки — важный компонент клеточной терапии, направленной на ускорение и оптимизацию лечения повреждений кожи. Стоит отметить, что в ранних исследованиях изучали мезенхимальные стромальные клетки костного мозга (МСКкм). Однако костный мозг — ограниченный ресурс, да и процедура по получению из него клеток очень болезненна. Поэтому в последнее время идет активный поиск альтернативных «депо» для извлечения МСК. Таковыми являются жировая ткань, эпидермальная ткань, амниотическая жидкость (рис. 1) [9]. Интересно, что биологический эффект МСК зависит не от места, откуда вы их взяли, а от микросреды, в которую поместили. Например, когда МСК попадают на место свежего повреждения, они работают на ускорение реэпителизации, а в месте, где реэпителизация уже прошла, — подавляют процесс образования шрама [8].
Рисунок 1. Применение МСК, выделенных из жировой ткани, в решении различных проблем, связанных с кожей.
Более продвинутой является терапия не самими МСК, а их экзосомами. Эффект от лечения такой же, как и при клеточной терапии; при этом у экзосом есть ряд преимуществ: они легко выделяются из клетки, не требуют особых условий хранения и транспортировки и могут быть применены в удобное для пациента время. При этом они обладают большой терапевтической эффективностью без риска образования опухолей или отторжения в результате иммунного ответа организма [10].
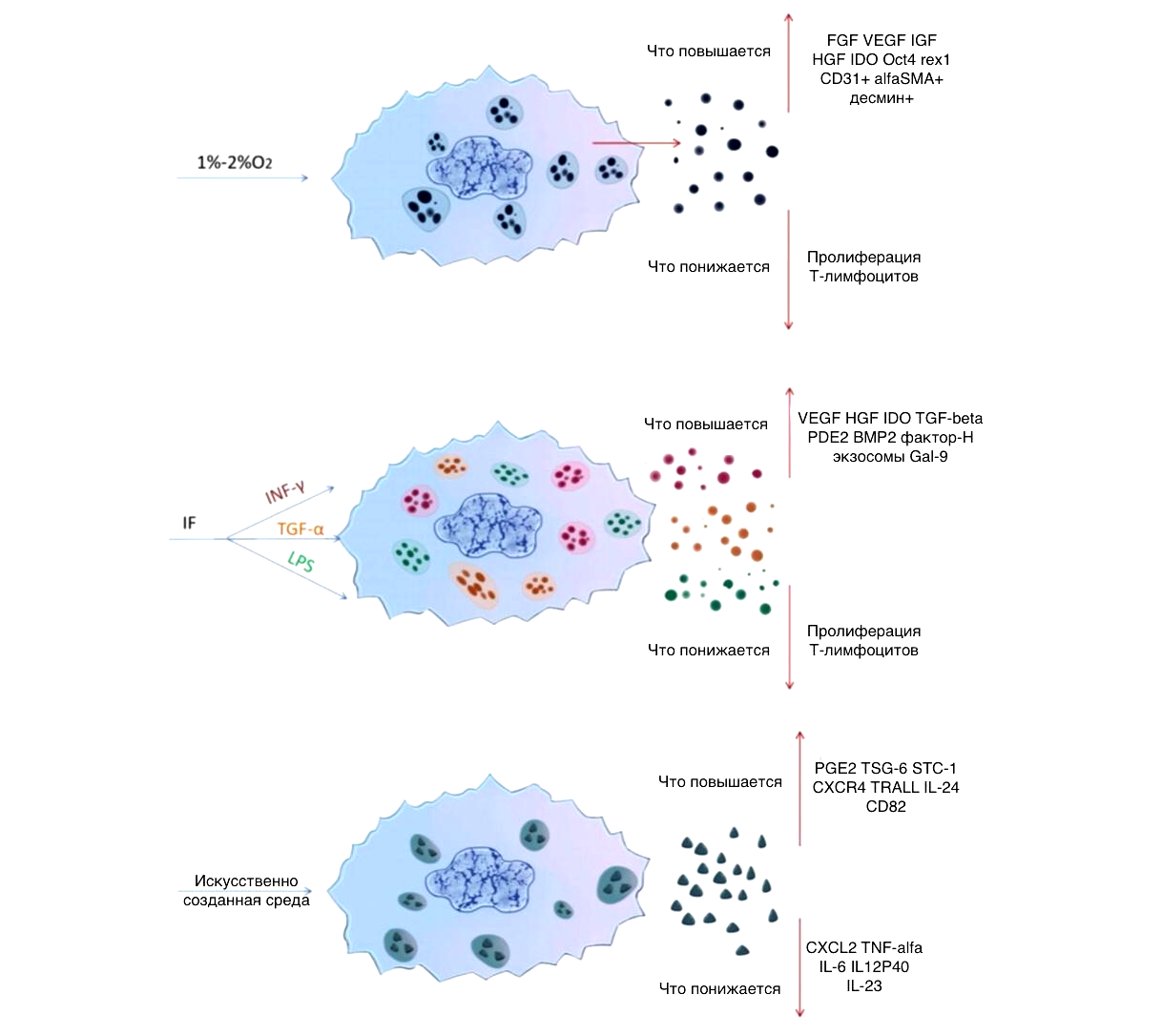
Недавние исследования открывают нам еще одно преимущество экзосом перед МСК: оказывается, экзосомы могут менять свой «коктейль» в зависимости от микросреды клетки, которая их продуцирует (рис. 2) [11]. В будущем это позволит ученым «подстраивать» экзосомы под конкретные задачи, например, для регенерации фибробластов или для высокоэффективного заживления раны.
Молекулярный механизм, обуславливающий терапевтический эффект мезенхимальных экзосом, требует более детального изучения, так как на данный момент большинство экспериментов проводились на животных.
Рисунок 2. Как изменения микросреды влияют на состав продуктов секреции МСК-экзосом.
Индуцированные плюрипотентные стволовые клетки
Индуцированные плюрипотентные стволовые клетки (иПСК) были открыты в 2006 году японским ученым Синъя Яманака. В 2012 году совместно с Джоном Гердоном он получил за эту разработку Нобелевскую премию.
Наша жизнь начинается, когда оплодотворенная яйцеклетка делится и образует дочерние клетки, которые, в свою очередь, продолжат делиться. Вначале все клетки полностью идентичны, но в процессе развития они превращаются в клетки различных тканей. Яманака предположил, что есть какие-то специальные гены, отвечающие за то, будет ли клетка стволовой или дифференцируется в специализированную клетку. В ходе экспериментов на мышах ученый действительно обнаружил четыре гена — Oct3/4, Sox2, Klf4 и cMyc — которые отвечают за индуцирование плюрипотентности в мышиных зародышевых и взрослых фибробластах. В активированном состоянии эти гены способны перепрограммировать клетки кожи мыши обратно в стволовые клетки, которые, в свою очередь, могут превратиться в любой тип клеток тела [12].
Плюрипотентные стволовые клетки неограниченно делятся и дифференцируются в клетки всех трех зародышевых листков. Эти две особенности делают ПСК привлекательным ресурсом для клеточной терапии различных болезней и травм. Человеческие индуцированные плюрипотентные стволовые клетки (чиПСК) были получены в 2007. С тех пор множество лабораторий провели клинические эксперименты на добровольцах, а некоторые из них даже внедрили методы клеточной терапии с использованием чиПСК в свою практику.
В дерматологии этот метод был применен недавно, однако уже сегодня есть результаты исследований, указывающие на то, что чиПСК, а точнее — их экзосомы — замедляют старение кожи и возобновляют процессы ее регенерации. Однако при работе с иПСК возникает ряд сложностей: например, они все же слегка отличаются от эмбриональных стволовых клеток, а также довольно часто оказываются онкогенными [12]. Подробнее об этом читайте в статье «Снежный ком проблем с плюрипотентностью» [13]. Экзосомы иПСК более «дружелюбны» по отношению к нашему организму и имеют меньше побочных эффектов, не уступая в количестве положительных.
Что могут экзосомы плюрипотентных стволовых клеток
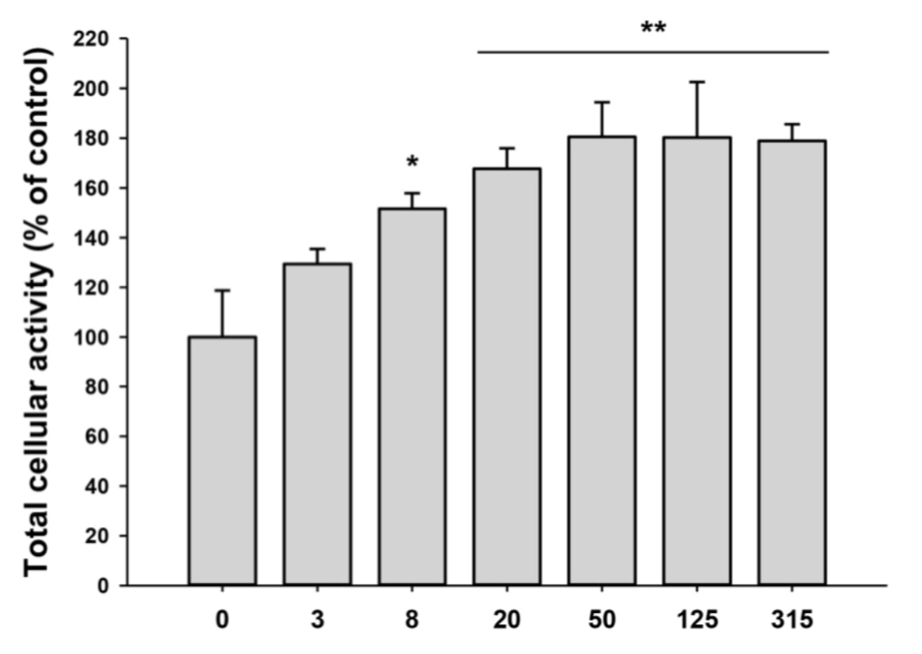
Во-первых, экзосомы иПСК ускоряют пролиферацию фибробластов (рис. 3). Интересно, что «передозировка» экзосомами практически невозможна: если доза слишком велика, то «лишние» экзосомы просто не проявляют никакой активности [14].
Рисунок 3. Влияние иПСК-экзосом на пролиферацию фибробластов у человека в течение 48 часов.
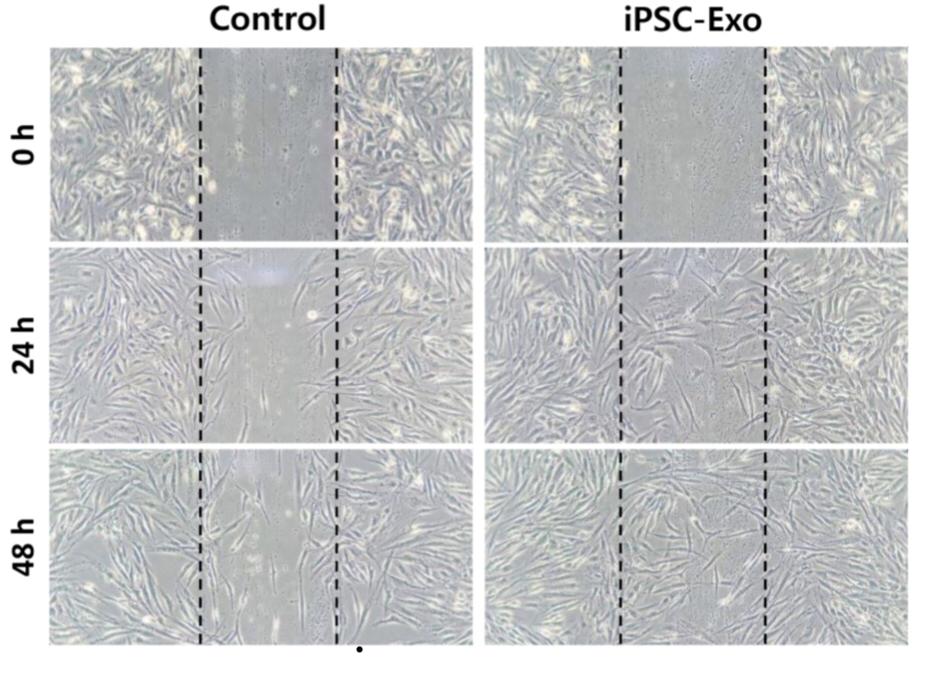
Кроме пролиферации, экзосомы иПСК повышают клеточную миграцию фибробластов, из-за чего восстановление кожи после механического повреждения идет быстрее. Для исследования эффекта иПСК-экзосом на миграцию фибробластов ученые наблюдали за изменением количества фибробластов на свежеповрежденном участке кожи. В результате стало ясно, что количественные показатели фибробластов, обработанных иПСК-экзосомами, куда выше, чем у контрольной группы (рис. 4).
Рисунок 4. Сравнение активности миграции фибробластов в контрольной группе и фибробластов, предварительно обработанных иПСК-экзосомами.
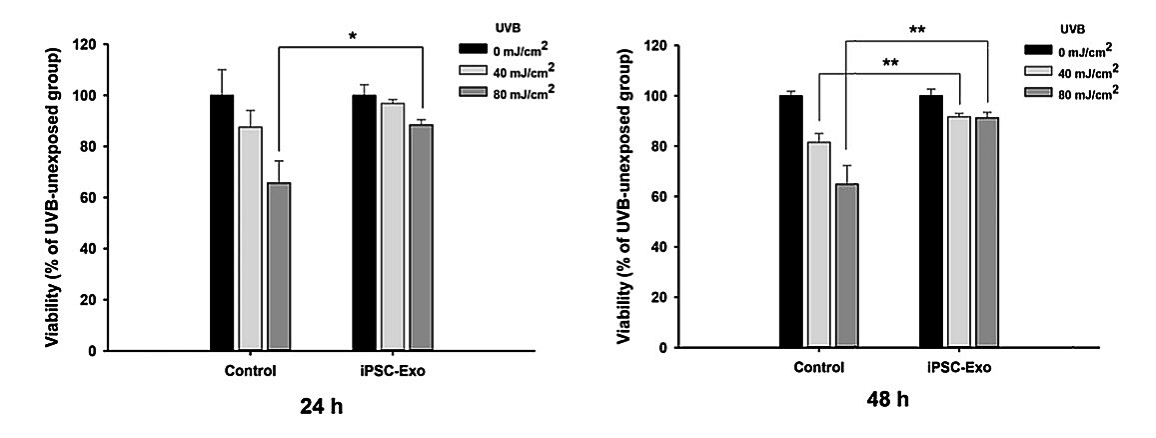
В начале статьи упоминалось пагубное влияние УФ-излучения на кожу: от его воздействия разрушаются нити коллагена, повреждаются фибробласты и увеличивается количество металлопротеиназ. Оказывается, иПСК-экзосомы могут помочь и здесь: они восстанавливают поврежденные фибробласты и повышают их жизнеспособность более чем на 20% (рис. 5)! Таким образом, через уменьшение негативного влияния ультрафиолета на фибробласты кожи, иПСК-экзосомы косвенно влияют на процессы регенерации и пролиферации кожи в целом [14].
Рисунок 5. Влияние иПСК-экзосом на клетки кожи, поврежденные в результате воздействия УФ-лучей.
Недостатки методов клеточной терапии кожи с участием стволовых клеток
Какими бы многообещающими ни были эксперименты со стволовыми клетками, их использование для терапии в последнее время теряет популярность. Основными причинами являются иммунный ответ организма в ответ на введение стволовых клеток донора и их последующее отторжение и онкогенность стволовых клеток в целом, а особенно иПСК. Это обусловлено репрограммирующими факторами (Oct3/4, Sox2, Klf4, и cMyc), которые связаны с онкогенезом, и генетическими мутациями, которые случаются при быстром делении стволовых клеток [12].
Поэтому ученые постепенно переходят от использования стволовых клеток в клеточной терапии к использованию исключительно самих экзосом, синтезируемых этими клетками. У экзосом куда меньшая онкогенность, они не вызывают иммунного ответа, а их регенеративный потенциал едва ли не выше, чем у стволовых клеток.
Экзосомная терапия: основные выводы и перспективы
На основе приведенных в обзоре экспериментов можно сделать вывод, что трансплантация МСК и иПСК в место повреждения кожи способна значительно снизить время регенерации пораженного участка, а также улучшить состояние рубцов и шрамов. Кроме того, экзосомы стволовых клеток, в частности иПСК-экзосомы, способны предотвращать внешнее старение кожи, вызванное УФ-излучением. При этом стоит учитывать ограничения в использовании стволовых клеток в силу их потенциальной онкогенности и вероятности отторжения донорских клеток в результате иммунного ответа. Решением данной проблемы может стать более безопасная экзосомная терапия.
Очевидно, что тема применения стволовых клеток различного происхождения и экзосом, секретируемых ими, довольно недавно открылась ученым и требует дополнительных исследований и клинических экспериментов, в том числе экспериментов на людях, чтобы точно выяснить механизмы работы экзосом и их поведение в тканях человека, а также изучить возможные подводные камни такого подхода и способы их преодоления. Однако уже на сегодняшний день можно утверждать, что экзосомная терапия — новый шаг как в лечении дерматитов различного происхождения, так и в сфере эстетической медицины в качестве омолаживающих процедур.
Обуздать воспаление: мезенхимальные стволовые клетки в терапии ожогов и обморожений
Обуздать воспаление: мезенхимальные стволовые клетки в терапии ожогов и обморожений
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Что такое терапия ожогов и обморожений? Это длительное консервативное лечение, включающее гели, мази, повязки. Это оперативное хирургическое вмешательство, при необходимости. Тут уже в ход идет пересадка донорской кожи или искусственных биотрансплантатов. Мы же предлагаем дополнить лечение мезенхимальными стволовыми клетками. С какой целью? Каким образом клетки могут увеличить эффективность лечения? На все вопросы найдем ответы.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
На нас двоих один фактор: особенности ожогов и обморожений
Наша кожа — наша «броня» от вредных воздействий внешнего мира: ультрафиолета, пыли, микроорганизмов. Но, к сожалению, она не стальная и существует очень много различных воздействий, которые могут нарушить целостность кожных покровов [1]. Наиболее распространенными нарушениями целостности кожи являются ранения. В первую очередь они ассоциируются с механическими травмами, которые сопровождаются рассечением кожного покрова, кровотечением и болью. Помимо этого, существует целый спектр физических и химических факторов, вызывающих наиболее сложные повреждения анатомической целостности кожи. Речь идет об ожогах и обморожениях. Несмотря на то, что оба этих вида повреждений могут быть обусловлены действием температур, они имеют ряд ключевых различий. Давайте разбираться.
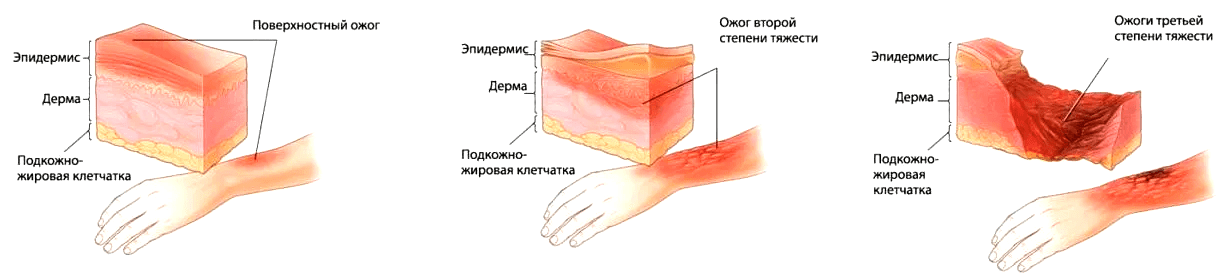
Начнем с одного из распространенных в мире травматических поражений — ожогов (рис. 1), которые могут быть обусловлены воздействием высоких температур, некоторых химических веществ (сильных кислот или щелочей), ионизирующими излучениями или электричеством. В тяжелом случае происходят два события: потеря ткани и чрезмерная воспалительная реакция. И тут необходима помощь специалистов, так как собственных сил организма становится недостаточно.
Рисунок 1. Стадии ожога согласно международной классификации
Теперь по порядку. Потеря тканей — это потеря того самого важного барьера, о котором мы говорили в начале. В этом случае используют повязки, донорские участки кожи самого пациента и, как альтернативу, биологически активные имплантаты, активно разрабатываемые сегодня [2]. Но сейчас касаться тканевой инженерии кожи мы не будем, а рассмотрим травму именно с точки зрения второго события — воспалительного процесса, неизменно сопровождающего потерю тканей.
Заживление ран включает в себя координацию многих отдельных физиологических процессов, которые регулируются секрецией различных цитокинов, хемокинов и факторов роста [3]. Все начинается с того, что увеличивается уровень провоспалительных медиаторов и цитокинов (интерлейкинов IL-1β, IL-6, IL-8, фактора некроза опухоли альфа), причем как системно, так и местно [4]. Их секреция необходима на начальных стадиях воспаления, но в случае сохранения их активации в течение всего заболевания возникают патологии, формируется хроническая рана [3]. Способствовать снижению продукции провоспалительных молекул может интерлейкин 10. Он стимулирует пролиферацию и дифференцировку Т-супрессоров, а также синтез интерлейкина 4, другого противовоспалительного цитокина.
Словарик
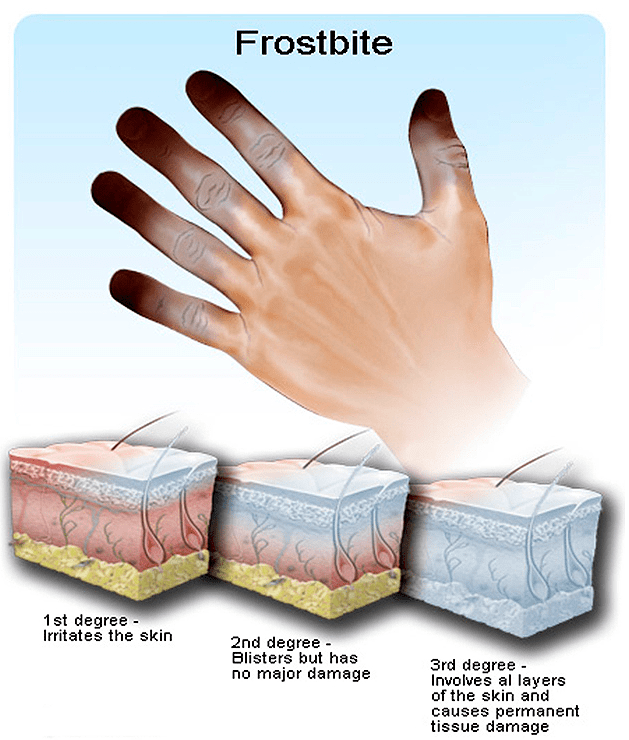
Чем же отличается повреждающее действие низких температур? Обморожение сопровождается потерей тканей и иммунным ответом, но при криотравме также имеет место синдром ишемии-реперфузии (рис. 2). Холод является причиной стойкого нейрорефлекторного спазма сосудов, приводящего к замедлению кровотока и ишемии. В свою очередь, ишемия сопровождается уменьшением кровенаполнения органа или ткани и снижением количества протекающей через них крови. Помимо этого, происходит прямое повреждение тканей, связанное с формированием кристаллов льда внутри и вне клеток, что приводит к разрушению клеточных мембран, нарушению внутриклеточного гомеостаза и, как следствие, к некрозу клеток [5]. Результатом ишемии и повреждений является отмирание тканей.
Рисунок 2. Стадии обморожения согласно международной классификации
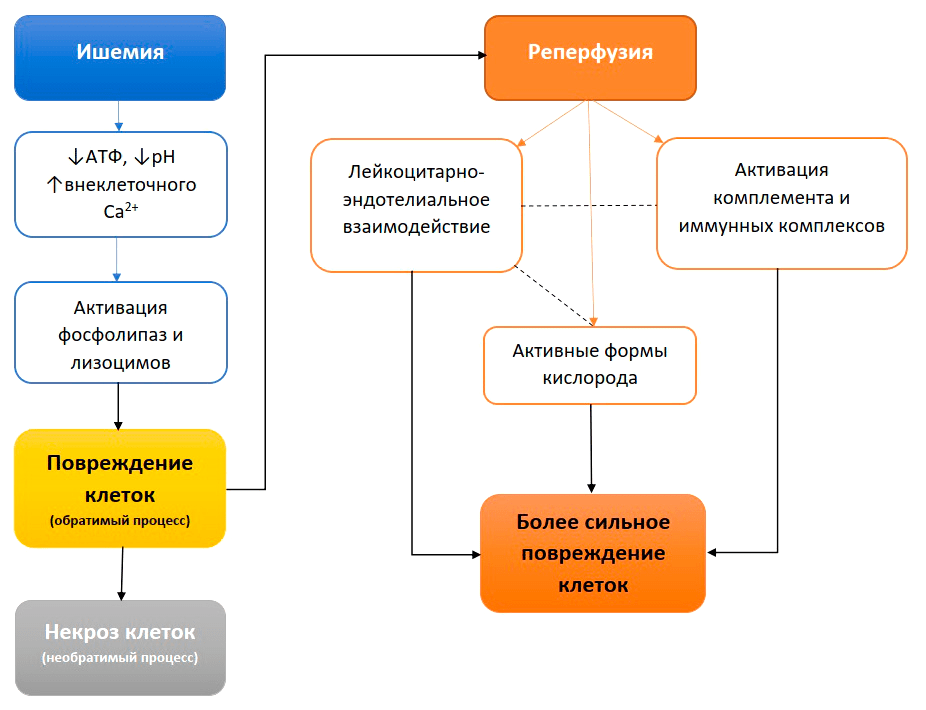
Что делают при обморожениях? Согревают пораженные участки, чтобы восстановить кровоток и остановить некроз тканей. Но восстановление кровообращения в ишемизированных тканях приводит к реперфузионному синдрому. Как результат, происходят еще более существенные повреждения клеток, тканей и органов на местном и системном уровнях (рис. 3). Причина кроется в биохимии процесса ишемии-реперфузии.
Рисунок 3. Последовательность событий синдрома ишемии-реперфузии
Сделаем шаг в сторону и вспомним про один универсальный источник энергии всех биохимических процессов, протекающих в живых системах, — аденозинтрифосфат (АТФ). Именно в его химических связях запасается энергия, которая высвобождается в ходе окисления углеводов, липидов и аминокислот. А уже совокупность биохимических реакций, во время которых происходит окисление этих веществ, называется клеточным дыханием. Следовательно, в случае недостатка кислорода снижается активность процессов окисления. Во время ишемии пораженные клетки становятся зависимыми от анаэробного гликолиза, который позволяет вырабатывать АТФ даже без кислорода. В результате в клетке происходит накопление лактата, протонов и NAD+ [6]. Затем активируются фосфолипазы, которые превращают фосфолипиды клеточной мембраны в предшественники медиаторов воспаления, и протеолитические ферменты лизоцимы [7].
Но тут мы решили согреть замороженные ткани и тем самым восстановить кровоток и доставку кислорода к клеткам. Происходит реперфузия — повторное наполнение сосудов кровью. Что происходит дальше? Главным образом, восстановление кровотока приводит к появлению активных форм кислорода (АФК), а они в свою очередь (они же активные) начинают окислять все, что «под молекулу подвернется», в том числе накопленные продукты метаболизма, о которых мы говорили ранее. Стоит отметить, что в клетках в ходе различных окислительно-восстановительных реакций регулярно образуются АФК, играющие значительную роль в регуляции основных функций, в том числе пролиферации и дифференцировки [8]. Только в нормальных условиях концентрация АФК регулируется, в частности, антиоксидантными ферментами митохондрий. В условиях ишемии-реперфузии митохондрии повреждены и плохо справляются с регуляцией концентрации активных форм кислорода, избыток которых способен нанести повреждение.
Но и это еще не все. Ранее было сказано, что фосфолипиды клеточной мембраны превращаются в медиаторы воспаления, которые, в свою очередь, привлекают лейкоциты в зону повреждения, а эндотелиальные клетки сосудов обеспечивают место их закрепления. При этом лейкоциты сами способны генерировать АФК и высвобождать хемотаксические агенты, привлекающие еще большее количество лейкоцитов.
Все это приводит к усилению повреждений клеток. АФК вызывают перекисное окисление липидов клеточной мембраны, и, в частности, способствуют высвобождению лейкоцитарных факторов [7]. В результате, происходит агрегация тромбоцитов и снижение перфузии тканей.
Подведем небольшой итог: в случае ожогов есть внешний агрессивный фактор (например температура), непосредственно приводящий к травме; в случае обморожений — температура является «катализатором» процессов, которые начинаются внутри организма и приводят к повреждениям. В любом случае все это сопровождается воспалением, выбросом различных медиаторов воспаления, цитокинов и факторов роста. Травма вызывает защитную реакцию иммунной системы организма, который рассчитывает только на себя и не знает меры. И в этот момент нужно обуздать воспаление, чтобы предотвратить опасные последствия безмерной самозащиты.
«Менеджеры по воспалению», или перспективы биомедицинского клеточного продукта
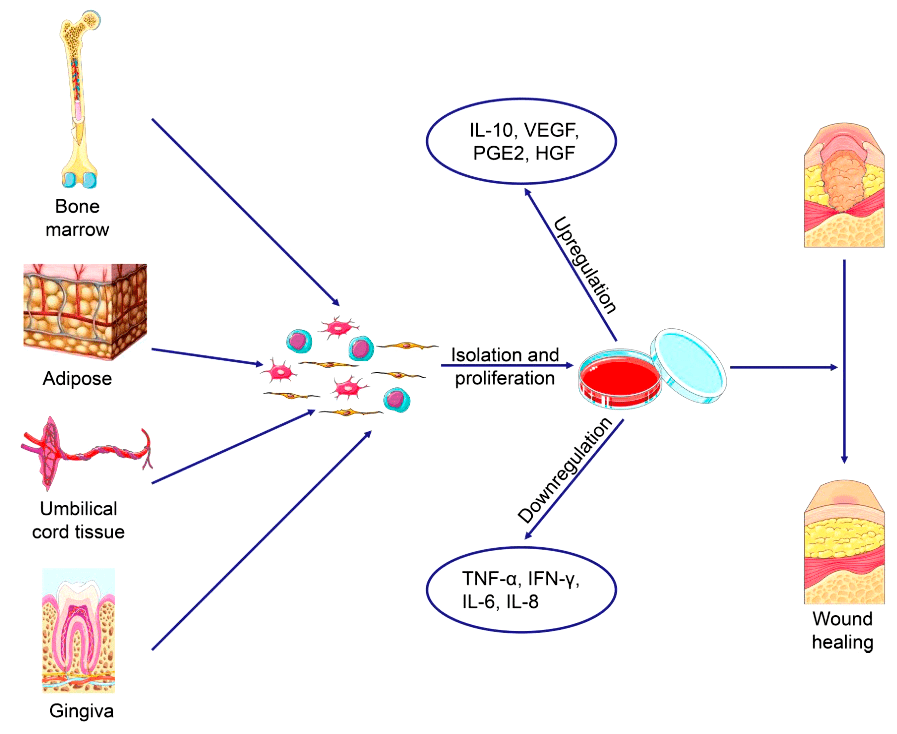
Лаборатория специальных клеточных технологий Физтеха, в которой работает автор, предлагает использовать в комплексной терапии ожогов и обморожений биомедицинский клеточный продукт на основе мезенхимальных стволовых клеток (МСК). МСК обладают выраженными иммуномодулирующими, антиапоптотическими, противовоспалительными и регенеративными свойствами [9]. Перспективы применения МСК обусловлены тремя ключевыми факторами.
Во-первых, мезенхимальные клетки в организме способны перемещаться в поврежденные участки. Миграция обусловлена как химическими (в направлении увеличения концентрации факторов роста и хемокинов, в частности, SDF-1), так и механическими (механическая деформация, напряжение сдвига, жесткость матрицы, микрогравитация) факторами [10].
Во-вторых, МСК могут дифференцироваться в локальные клетки. Правда, вклад трансдифференцировки стволовых клеток в специфические при репарации тканей все еще остается спорным, поскольку частота дифференцировки имплантированных МСК в ткани-мишени довольно низка [11].
В-третьих, клетки способны секретировать хемокины, цитокины и факторы роста, способствующие регенерации тканей. И на этом мы остановимся подробнее, так как основным механизмом терапевтического влияния МСК является именно паракринная секреция биоактивных молекул [12]. Широкий спектр секретируемых молекул позволяет МСК взаимодействовать с клетками, принадлежащими к адаптивной иммунной системе, а также с компонентами врожденного иммунного ответа. Это обеспечивает как про-, так и противовоспалительное действие [13].
Стоит перечислить, какие трофические факторы, активно участвующие в заживлении, секретируют мезенхимальные стволовые клетки. В числе этих активных молекул стромальный фактор (SDF-1), фактор роста гепатоцитов (HGF), инсулиноподобный фактор роста (IGF-1), эпидермальный фактор роста (EGF), фактор роста нервов (NGF), трансформирующий фактор роста (TGFα) и фактор роста эндотелия сосудов (VEGF). Помимо этого, МСК продуцируют важный противовоспалительный интерлейкин 10 (IL-10) [14].
Не стоит забывать, что для использования на практике мы рассматриваем потенциальный биомедицинский клеточный продукт (БМКП), к которым сегодня существует множество этических вопросов. Одной из проблем БМКП является доступность клеток для терапии. В этом случае стоит отметить, что МСК могут быть выделены из широкого спектра доступных источников: костного мозга, пуповины, жировой ткани, печени [15]. Другой важной этической проблемой для БМКП является сложность прогнозирования последствий, к которым приведет применение препарата. Необходимо уточнить, что мезенхимальные клетки являются мультипотентными клетками. Они могут дифференцироваться в клетки разных тканей, но многообразие их видов ограничено пределами одного зародышевого листка. В частности, они могут дифференцироваться преимущественно в остеогенном (костная ткань), хондрогенном (хрящевая ткань) и адипогенном (жировая ткань) направлениях. Стоит подчеркнуть, именно «преимущественно», так как из МСК можно получить и другие типы клеток, но в определенных условиях культивирования. Помимо этого, частота дифференцировки низкая, как уже было сказано ранее. Тем не менее, несмотря на сложность предсказания последствий терапии, применение мезенхимальных стволовых клеток преодолевает имеющиеся этические проблемы [16], что, безусловно, является еще одним их преимуществом. Продолжение исследований позволит решить все этические проблемы и сделать терапию с использованием МСК максимально безопасной.
Рисунок 4. Стратегии заживления ран: мезенхимальные стволовые клетки выделяют и идентифицируют, после клетки культивируют в соответствующих условиях. Чтобы осуществить регенерацию кожи, МСК секретируют множество факторов, модулирующих воспаление и индуцирующих ангиогенез.
Все это делает мезенхимальные стволовые клетки перспективными для клеточной терапии, регенеративной медицины и восстановления тканей, но существует одно важное ограничение. Какими универсальными «бойцами» они бы не были, у них есть ахиллесова пята. Местное введение клеток в зону раневого воспаления поврежденных тканей приводит к гибели значительного количества инъецированных МСК. Это связано с тем, что в данной зоне происходит значительный выброс воспалительных медиаторов, сопровождающийся окислительным стрессом [17].
Как можно увеличить жизнеспособность клеток при трансплантации? Какие условия и методики позволят увеличить секрецию биологически активных молекул и, тем самым, повысить эффективность БМКП на основе мезенхимальных стволовых клеток? Другими словами, поговорим о биотехнологической эксплуатации.
Объясняем клеткам, что их ждет, и морально готовим к стрессу
Улучшение регенеративных свойств и пролиферации клеток мы начали с изучения влияния и подбора оптимальных условий культивирования МСК. При культивировании клеток в инкубаторе в стандартных условиях содержание кислорода — 21%, как и в атмосфере. Но в тканях концентрация кислорода значительно ниже. В частности, физиологической гипоксии соответствует содержание кислорода 2–9% [18]. Поэтому культивирование МСК проводили как в условиях нормоксии (21% кислорода в атмосфере, культура «МСК-нормоксия»), так и в условиях гипоксии (5% кислорода, культура «МСК-гипоксия»). Таким образом, мы выделили мезенхимальные клетки из костного мозга и сразу поместили их в разные условия. Оценка пролиферации и секреции факторов роста, в том числе после переноса клеток из одних условий в другие, показали главный результат — культивирование в условиях низкого содержания кислорода в атмосфере позволяет увеличить секрецию факторов роста и пролиферацию МСК.
Результат обусловлен тем, что клетки оказываются в условиях стресса, им приходится выживать, но тут необходимо вспомнить о физиологической гипоксии. Сам факт ее существования свидетельствует о том, что клетки должны быть адаптированы к данным условиям. Они имеют пару ключевых сигнальных путей PI3K-Akt и HIF-1α, которые активируются при недостатке кислорода.
Знакомимся: первый из них — главный регулятор энергетического обмена, выживания и пролиферации Akt (серин/треониновая протеинкиназа), способная повышать содержание АТФ в клетках и стимулировать гликолиз, интенсифицируя анаболические и катаболические процессы [19].
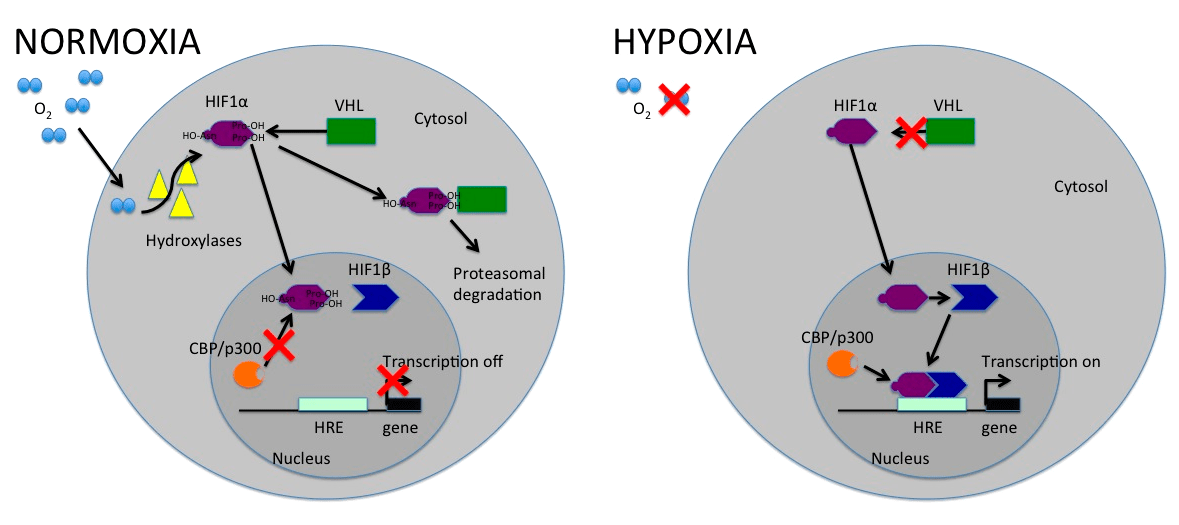
Второй регулятор — HIF-1α — основной транскрипционный фактор, участвующий в регуляции нескольких сотен генов в ответ на гипоксию (рис. 5). Гены кодируют белки, многие из которых способствуют энергетическому обмену, васкуляризации, иммортализации клеток в целом. HIF-1α есть всегда, но при нормальном содержании кислорода он появляется, чтобы быть уничтоженным. Механизм следующий: под действием кислорода происходит гидроксилирование ферментом ряда аминокислотных остатков на поверхности HIF. Это является причиной связывания опухолевого супрессора VHL, который и обеспечивает последующую деградацию фактора HIF-1α в протеасоме. Но как только кислорода становится недостаточно, гидроксилирование не происходит, и HIF вступает в игру, точнее, отправляется в ядро [20]. И тут довольно простая логика: чем меньше кислорода, тем выше активность HIF — сигнального пути. Но не стоит забывать, что кислород нужен клетке для большинства метаболических процессов, и полностью лишить ее жизненно необходимых молекул мы не можем.
Рисунок 5. Передача сигналов, связанных с HIF-1α в условиях нормоксии и гипоксии
Культивирование в условиях недостатка кислорода способствовало увеличению пролиферации клеток и секреции цитокинов и факторов роста, поэтому мы перешли к следующему этапу — доклиническим испытаниям. Первая часть доклиники была завершена в предыдущем году. В результате мы подтвердили безопасность продукта при аллогенной терапии. Сейчас идет следующий, ключевой этап — оценка эффективности терапии. Ранее разработанные модели обморожения и механической травмы у крыс и химического ожога у мышей позволят сравнить терапию с использованием культуры МСК, культивируемых в условиях гипоксии, с терапией МСК, выращенными в стандартных условиях.
Собираем клетки в сфероиды и пласты
В последние годы в регенеративной медицине активно используются 3D-культуры стволовых клеток [21], поэтому дополнительно мы рассматриваем возможность повышения секреции и пролиферации клеток путем создания 3D-структур.
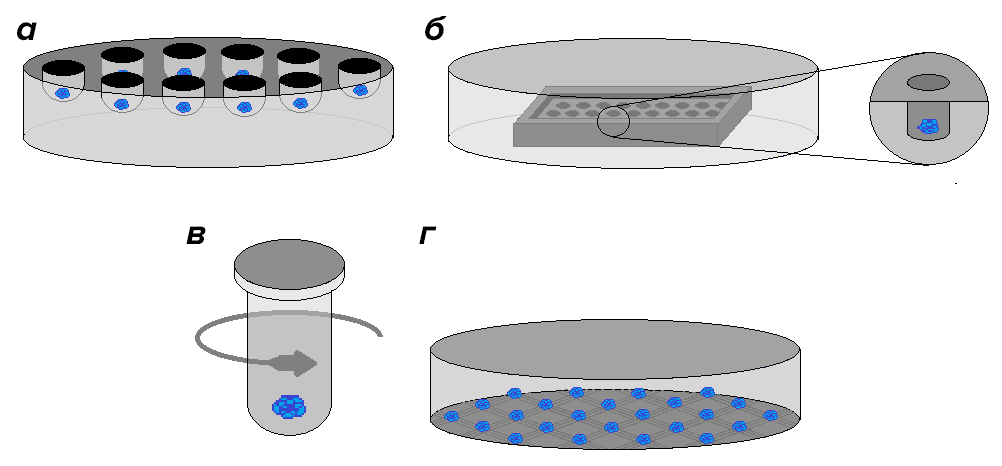
Во-первых, из клеток можно получить сфероиды — тканеподобные агрегаты клеток сферической формы. Необходимо отметить, что мезенхимальные стволовые клетки — это адгезивная клеточная культура, следовательно, для получения сфероидов клетки должны быть во взвешенном состоянии. Существует множество различных способов получения сфероидов, часть из которых представлена на рисунке 6. Мы использовали специальные агарозные подложки, препятствующих адгезии клеток (рисунок 6б).
Рисунок 6. Техники получения сфероидов. а — Метод «висячей капли». б — Метод с применением низкоадгезивных субстратов (подложек). в — Метод принудительной агрегации. г — Метод с использованием специальных мембран.
рисунок автора статьи
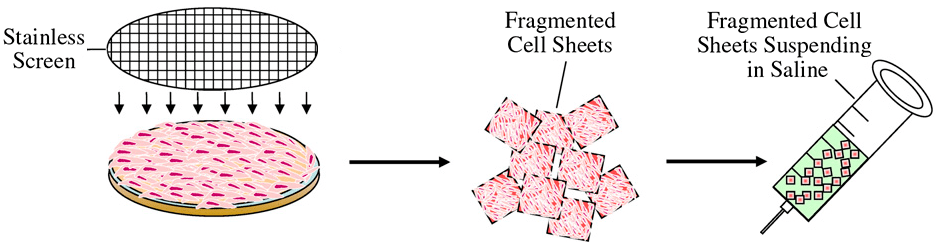
Во-вторых, из клеток можно получить пласты — структуры, состоящие из нескольких слоев. Причем их можно использовать как для нанесения на поврежденную ткань, так и вводить внутримышечно, как в 2007 году предложил Чен с соавторами (рис. 7) [22]. Обычно МСК никогда не выращивают до плотности в 100%, когда клетки полностью покрывают поверхность подложки. Это связано с тем, что, достигая ее, клетки быстро начинают погибать. Поэтому исследователи идут на хитрость. В нашем случае мы нашли и опробовали относительно простой способ получения — длительное (10–14 суток) культивирование клеток в монослое с добавлением витамина С в питательную среду [23]. Предположительно, формирование пластов под действием аскорбиновой кислоты может быть обусловлено ее основными физиологическими свойствами, среди которых — стимуляция пролиферации [24], подавление апоптоза, ключевая роль в биосинтезе коллагена и других компонентов внеклеточного матрикса [25].
Рисунок 7. Способ получения фрагментированных клеточных пластов
На данный момент проведены исследования, показавшие бóльшую секрецию факторов роста сфероидами и пластами по сравнению с клетками в монослое (с плотностью клеток около 90%).
А теперь давайте разберемся, с чем связана перспективность 3D-культивирования. Чем может быть выгодно применение более сложных структур в терапии вместо суспензии единичных клеток?
Во-первых, это предпочтительно из-за присутствия в сфероидах и пластах очагов гипоксии, то есть условий, которые были описаны выше. Во-вторых, клетки в тесном контакте друг с другом, при наличии некоторого внеклеточного матрикса между ними, более жизнеспособны в пораженных тканях. Вроде бы какая разница, можно ведь просто ввести большее количество обычных культур клеток! Но нет, внеклеточный матрикс также играет значительную роль и не только как механическая поддержка, но и как «концентратор» клеток и секретируемых ими активных биомолекул. Кроме того, при введении агрегатов не нужно использовать протеолитические ферменты, необходимые для снятия клеток перед инъекционным введением.
В заключение стоит отметить, что на сегодняшний день имеются данные о ряде доклинических исследований, показавших ослабление прогрессирования ожоговой раны после местного введения аллогенных МСК. Таким образом, локально введенные клетки могут улучшить динамику заживления ран. Продемонстрированные защитные и трофические эффекты введенных МСК позволяют предположить, что клетки способны улучшить исход острых термических повреждений и снизить потребность в аутотрансплантации кожи в клинических условиях [26]. Что касается обморожений, данных о проведенных исследованиях на животных нет. Но значительное количество публикаций, связанных с применением мезенхимальных клеток в терапии ишемически-реперфузионных травм различных органов [27], [28], позволяет предположить эффективность БМКП на основе МСК и для лечения обморожений.
В этой статье мы целенаправленно рассматриваем несколько биотехнологических подходов улучшения регенеративных свойств клеток неразрывно с дальнейшим применением разрабатываемой клеточной терапии. По неопубликованным данным автора и ее коллег, культивирование в условиях гипоксии и получение клеточных 3D-структур позволяет увеличить секрецию факторов роста, что является ключевой характеристикой регенеративных свойств терапии ожогов и обморожений с использованием МСК. Существуют и другие методики, например, генетическая модификация или включение клеток в полимерные биоматериалы. Об этих перспективных методах в этом материале мы не рассказали, но, возможно, сделаем это в будущем.
Впереди много неразрешенных вопросов, еще больше исследований, но одно мы знаем точно. Терапия ожогов и обморожений оценивается по значительному количеству параметров, начиная с восстановления физиологической активности тканей и заканчивая косметическими результатами. Поэтому использование биомедицинского клеточного продукта на основе мезенхимальных стволовых клеток может стать большим шагом в направлении создания новых подходов к лечению ожогов и обморожений.
Биомолекулы, упоминаемые в статье
Благодарности
Автор благодарит своего научного руководителя, к.б.н. Михаила Олеговича Дурыманова и коллег за помощь в подготовке статьи.
Работа выполняется при финансовой поддержке Министерства науки и высшего образования РФ в рамках соглашения о предоставлении субсидии № 14.575.21.0179 от 28 ноября 2018 г. Уникальный идентификатор проекта: RFMEFI57518Х0179.