митохондриальная миопатия что это
Митохондриальная миопатия что это
Митохондриальные миопатии — это группа заболеваний мышц, которые возникают в результате нарушения функции тканевого дыхания при патологиях митохондрий. Болезни проявляются нарастающей мышечной слабостью, атрофией мускулатуры, прогрессирующими двигательными расстройствами, которые могут сопровождаться судорогами, поражениями сердца, ухудшением слуха и зрения. Диагностика предполагает лабораторные (исследование мышечных биоптатов, генетическое тестирование, биохимические анализы), инструментальные методы (ЭМГ, церебральное МР-сканирование). Лечение включает симптоматические препараты, физиотерапию, ЛФК.
МКБ-10
Общие сведения
Термин «митохондриальная миопатия» объединяет в себе несколько патологий со сходным патогенезом. Наиболее часто дети страдают синдромами MELAS, MERRF, синдромом Кернса-Сайра с хронической прогрессирующей наружной офтальмоплегией. Изучение молекулярно-генетических особенностей этих болезней началось в 1980-х гг. Распространенность патологий у детей составляет около 11,5 случая на 100 тыс. населения. Из-за мультисистемности поражения, клинического полиморфизма, вариабельности течения этот вид миопатии представляет серьезные трудности в диагностике.

Причины
Миопатии обусловлены наследственными либо спорадическими мутациями в митохондриальной ДНК или в ядерных генах, контролирующих работу митохондрий. Известно более 300 вариантов генных дефектов — однонуклеотидных замен, делеций, вызывающих нарушения функционирования митохондрий. Митохондриальные миопатии имеют ряд генетических аспектов, выделяющих их среди всех наследственных заболеваний. Принципиальные различия:
Патогенез
Митохондрия — универсальная органелла, присутствующая во всех клетках, кроме эритроцитов. Она имеет дыхательную цепь, которая включает 5 ферментных комплексов из нескольких десятков субъединиц каждый. Ферменты обеспечивают окислительное фосфорилирование для синтеза АТФ — аденозинтрифосфата, выступающего основным источником энергии в организме.
При митохондриальных заболеваниях может быть 4 варианта патогенетических механизмов развития. Как правило, при поражениях мышц наблюдаются дефекты электронного транспорта и окислительного фосфорилирования, что сопровождается нарушениями образования энергетических молекул. Другие варианты расстройств включают нарушения обмена пирувата, дефекты метаболизма жирных кислот, дисфункцию цикла Кребса.
При миопатиях отмечаются полисистемные расстройства. Мышечная и нервная ткань, больше других зависимые от энергопроизводства, страдают в первую очередь. Поражение проявляется нарушениями обмена веществ в мышцах, дегенеративными процессами, атрофией миофибрилл и их замещением соединительной тканью. Со временем патологический процесс распространяется на сердечную мышцу, эндокринную систему, почки и печень, что определяет различные «маски» миопатии.
Симптомы митохондриальной миопатии
Патологии манифестируют у детей раннего возраста, иногда они присутствуют с рождения. Общим признаком является миопатический синдром, который включает прогрессирующую мышечную слабость, снижение тонуса скелетной мускулатуры, непереносимость физических нагрузок. Типично отставание в моторном развитии: дети поздно начинают сидеть, ползать, ходить, у них сохраняется неуклюжесть движений, проблемы с поддержанием равновесия.
Клинические особенности определяются типом заболевания. При синдроме MERRF мышечная слабость сопровождается разнообразными судорожными приступами (атоническими, тонико-клоническими, миоклоническими), расстройствами координации вследствие мозжечковой атаксии. Для синдрома MELAS характерны повторные инсульты, умственная отсталость, нейросенсорная тугоухость.
У детей распространен синдром Кернса-Сайра, при котором клинические признаки дополняются расстройствами глотания, нарушениями работы проводящей системы сердца, снижением слуха. Хроническая прогрессирующая наружная офтальмопатия может возникать как компонент болезни Кернса-Сайра, так и развиваться изолированно, что чаще бывает в старшем возрасте.
Осложнения
Отличительными особенностями миопатического синдрома являются необратимость, неуклонное прогрессирование. Сначала мышечная слабость появляется в проксимальных отделах конечностей, затем поражает все тело ребенка: в процесс вовлекается гладкая мускулатура органов дыхания и пищеварения, что чревато дыхательной недостаточностью, аспирационными пневмониями, тотальным параличом. Такие пациенты теряют способность к самообслуживанию, требуют круглосуточного ухода.
Миопатии осложняются деформациями позвоночника, искривлениями нижних конечностей на фоне слабости мышечного корсета. Вследствие атрофии зрительных нервов у больных с синдромом MERRF возникает слепота. Опасным последствием многих вариантов митохондриальной патологии являются инсульты, эпилептический статус, мозговой отек, которые становятся основными причинами летального исхода.
Диагностика
Первичное обследование детей с подозрением на митохондриальную миопатию проводится у невролога, для уточнения диагноза показана консультация генетика. При осмотре учитывается неврологический статус ребенка, показатели мышечной силы и тонуса, уровень развития когнитивных навыков. Постановка диагноза требует комплексного обследования, включающего следующие методы:
Лечение митохондриальных миопатий
В клинической неврологии отсутствуют эффективные методы терапии патологии у детей. Суть медицинской помощи сводится к уменьшению моторного дефицита, своевременной коррекции осложнений, стимуляции обменных процессов в митохондриях. Наибольшую результативность демонстрируют следующие группы медикаментов:
Важным компонентом лечения у детей является нейродиетология, которая предполагает исключение веществ, оказывающих негативное влияние на обменные процессы (терапия «обхождения блока»). Рекомендована кетогенная диета, другие виды высокожировых диет. По показаниям проводится лечебное энтеральное или парентеральное питание, в тяжелых случаях устанавливается гастростома.
Прогноз и профилактика
Вы можете поделиться своей историей болезни, что Вам помогло при лечении митохондриальной миопатии.
1. Митохондриальные болезни: миопатии, энцефаломиопатии и энцефаломиелополиневропатии/ В.М. Казаков, А.А. Скоромец, Д.И. Руденко, Т.Р. Стучевская// Неврологический журнал. — 201 — №
2. Митохондриальная патология у детей/ В.М. Студеникин, О.В. Глоба// Лечащий врач. — 201 — №
3. Влияние дисфункции митохондрий на клинические проявления наследственных миопатий/ Д.А. Харламов, В.С. Сухоруков// Российский вестник перинатологии и педиатрии. — 201 — №
4. Митохондриальные миопатии в сочетании с кардиомиопатией. Новые подходы к лечению/ О.С. Страхова, Ю.М. Белозеров, С.В. Перминов, В.В. Давыдкин// Альманах клинической медицины. — 200 — №
Митохондриальная миопатия
Митохондриальные миопатии — это группа заболеваний мышц, которые возникают в результате нарушения функции тканевого дыхания при патологиях митохондрий. Болезни проявляются нарастающей мышечной слабостью, атрофией мускулатуры, прогрессирующими двигательными расстройствами, которые могут сопровождаться судорогами, поражениями сердца, ухудшением слуха и зрения. Диагностика предполагает лабораторные (исследование мышечных биоптатов, генетическое тестирование, биохимические анализы), инструментальные методы (ЭМГ, церебральное МР-сканирование). Лечение включает симптоматические препараты, физиотерапию, ЛФК.
МКБ-10
Общие сведения
Термин «митохондриальная миопатия» объединяет в себе несколько патологий со сходным патогенезом. Наиболее часто дети страдают синдромами MELAS, MERRF, синдромом Кернса-Сайра с хронической прогрессирующей наружной офтальмоплегией. Изучение молекулярно-генетических особенностей этих болезней началось в 1980-х гг. Распространенность патологий у детей составляет около 11,5 случая на 100 тыс. населения. Из-за мультисистемности поражения, клинического полиморфизма, вариабельности течения этот вид миопатии представляет серьезные трудности в диагностике.
Причины
Миопатии обусловлены наследственными либо спорадическими мутациями в митохондриальной ДНК или в ядерных генах, контролирующих работу митохондрий. Известно более 300 вариантов генных дефектов — однонуклеотидных замен, делеций, вызывающих нарушения функционирования митохондрий. Митохондриальные миопатии имеют ряд генетических аспектов, выделяющих их среди всех наследственных заболеваний. Принципиальные различия:
Патогенез
Митохондрия — универсальная органелла, присутствующая во всех клетках, кроме эритроцитов. Она имеет дыхательную цепь, которая включает 5 ферментных комплексов из нескольких десятков субъединиц каждый. Ферменты обеспечивают окислительное фосфорилирование для синтеза АТФ — аденозинтрифосфата, выступающего основным источником энергии в организме.
При митохондриальных заболеваниях может быть 4 варианта патогенетических механизмов развития. Как правило, при поражениях мышц наблюдаются дефекты электронного транспорта и окислительного фосфорилирования, что сопровождается нарушениями образования энергетических молекул. Другие варианты расстройств включают нарушения обмена пирувата, дефекты метаболизма жирных кислот, дисфункцию цикла Кребса.
При миопатиях отмечаются полисистемные расстройства. Мышечная и нервная ткань, больше других зависимые от энергопроизводства, страдают в первую очередь. Поражение проявляется нарушениями обмена веществ в мышцах, дегенеративными процессами, атрофией миофибрилл и их замещением соединительной тканью. Со временем патологический процесс распространяется на сердечную мышцу, эндокринную систему, почки и печень, что определяет различные «маски» миопатии.
Симптомы митохондриальной миопатии
Патологии манифестируют у детей раннего возраста, иногда они присутствуют с рождения. Общим признаком является миопатический синдром, который включает прогрессирующую мышечную слабость, снижение тонуса скелетной мускулатуры, непереносимость физических нагрузок. Типично отставание в моторном развитии: дети поздно начинают сидеть, ползать, ходить, у них сохраняется неуклюжесть движений, проблемы с поддержанием равновесия.
Клинические особенности определяются типом заболевания. При синдроме MERRF мышечная слабость сопровождается разнообразными судорожными приступами (атоническими, тонико-клоническими, миоклоническими), расстройствами координации вследствие мозжечковой атаксии. Для синдрома MELAS характерны повторные инсульты, умственная отсталость, нейросенсорная тугоухость.
У детей распространен синдром Кернса-Сайра, при котором клинические признаки дополняются расстройствами глотания, нарушениями работы проводящей системы сердца, снижением слуха. Хроническая прогрессирующая наружная офтальмопатия может возникать как компонент болезни Кернса-Сайра, так и развиваться изолированно, что чаще бывает в старшем возрасте.
Осложнения
Отличительными особенностями миопатического синдрома являются необратимость, неуклонное прогрессирование. Сначала мышечная слабость появляется в проксимальных отделах конечностей, затем поражает все тело ребенка: в процесс вовлекается гладкая мускулатура органов дыхания и пищеварения, что чревато дыхательной недостаточностью, аспирационными пневмониями, тотальным параличом. Такие пациенты теряют способность к самообслуживанию, требуют круглосуточного ухода.
Миопатии осложняются деформациями позвоночника, искривлениями нижних конечностей на фоне слабости мышечного корсета. Вследствие атрофии зрительных нервов у больных с синдромом MERRF возникает слепота. Опасным последствием многих вариантов митохондриальной патологии являются инсульты, эпилептический статус, мозговой отек, которые становятся основными причинами летального исхода.
Диагностика
Первичное обследование детей с подозрением на митохондриальную миопатию проводится у невролога, для уточнения диагноза показана консультация генетика. При осмотре учитывается неврологический статус ребенка, показатели мышечной силы и тонуса, уровень развития когнитивных навыков. Постановка диагноза требует комплексного обследования, включающего следующие методы:
Лечение митохондриальных миопатий
В клинической неврологии отсутствуют эффективные методы терапии патологии у детей. Суть медицинской помощи сводится к уменьшению моторного дефицита, своевременной коррекции осложнений, стимуляции обменных процессов в митохондриях. Наибольшую результативность демонстрируют следующие группы медикаментов:
Важным компонентом лечения у детей является нейродиетология, которая предполагает исключение веществ, оказывающих негативное влияние на обменные процессы (терапия «обхождения блока»). Рекомендована кетогенная диета, другие виды высокожировых диет. По показаниям проводится лечебное энтеральное или парентеральное питание, в тяжелых случаях устанавливается гастростома.
Прогноз и профилактика
Митохондриальная миопатия что это
Митохондриальные миопатии встречаются относительно редко, но внутри этой группы болезней часто наблюдаются поражения ЦНС и нервно-мышечной системы. Разделение чисто миопатических и более комплексных форм в некоторой степени искусственно, так как митохондрии имеются в каждой клетке. Неравномерная гетероплазмия, из-за которой, вероятно, в скелетной мускулатуре могут преобладать патогенные митохондриальные мутации по сравнению с другими тканями, может также вызывать выраженное поражение преимущественно мышечной ткани и симптоматику миопатии, что может иметь и иные объяснения (DiMauro и Gurgel-Giannetti, 2005).
Изменчивые клинические проявления и сложность методов исследований, необходимых для постановки точного этиопатогенетического диагноза, превращают эти расстройства в сложную задачу для клиницистов. Тем не менее, существует несколько распознаваемых синдромов, и их генетические, биохимические, патофизиологические и клинические проявления изучаются все больше (Schapira и Cock, 1999; DiMauro и Gurgel-Giannetti, 2005; DiMauro и Hirano, 2005).
Митохондриальная дисфункция может развиться на любом этапе митохондриального метаболизма липидов и других соединений. Эти проблемы обсуждаются в отдельной статье на сайте. В данном разделе описаны только миопатии при митохондриальных болезнях, вызванных дисфункцией системы переноса электронов (дыхательной цепи).
а) Клинические проявления. Митохондриальные миопатии могут проявиться в любой период от рождения до взрослого возраста и чрезвычайно разнообразны по симптоматике, тяжести и исходу (Harding et al., 1988; DiMauro 1993). Некоторые являются составной частью комплексных энцефаломиопатий (глава 8), тогда как другие полностью или преимущественно ограничены патологией поперечнополосатой мускулатуры.
При клиническом проявлении в виде чисто миопатического процесса со слабостью преимущественно проксимальных отделов конечностей, такие симптомы, как утомляемость, миалгия, непереносимость физических нагрузок (легкая нагрузка вызывает непропорциональные тахикардию и диспноэ) и эпизодическая вызванная физической нагрузкой миоглобулинурия, хотя и не являются патогномоничными симптомами, являются ключевыми при постановке диагноза. Птоз и прогрессивная наружная офтальмоплегия — очень важные диагностические признаки (Moraes et al., 1989), так же, как и наличие кардиомиопатии.
Часто наряду с миопатией наблюдаются другие проявления мультисистемного поражения, что способствует синдромальной диагностике, например синдрома Кернса-Сейра. В исследовании Jackson et al. (1995) важными признаками расстройств дыхательной цепи явились материнское наследование, глухота и офтальмоплегия. Отсутствие прибавки в весе, пигментный ретинит, диабет, нарушения интеллекта, припадки и мозжечковая атаксия также имеют диагностическое значение. Гипотония может быть выраженной, но она имеет меньшее значение при дифференциальной диагностике.

Обратите внимание на красные отложения—скопления митохондрий — под сарколеммой наиболее пораженных волокон.
Те же, но менее выраженные изменения начинают развиваться и в других волокнах.
б) Методы исследований. Если клинически не удается распознать имеющийся синдром, первые диагностические признаки, полученные при помощи лабораторных и инструментальных методов исследования, указывающие на патологические изменения в дыхательной цепи — это повышение уровня лактата в крови и ЦСЖ или аномалии базальных ганглиев, выявленные при лучевом исследовании (Jackson et al., 1995). При некоторых описанных синдромах, обычно не проявляющихся преимущественно миопатией (напр. MELAS, MERRF, NARP), мутации можно выявить при исследовании циркулирующих в крови лейкоцитов, таким образом, исчезает необходимость выполнения биопсии.
Даже если отсутствует выраженная слабость, гистологическое и гистохимическое исследование мышечной ткани дает указания или подтверждает диагноз митохондриального расстройства. Характерные морфологические аномалии, лучше всего видные при трехцветной окраске по Гомори, — это так называемые рваные красные мышечные волокна, возникающие из-за скопления митохондрий под сарколеммой. При электронной микроскопии можно выявить патологические митохондриальные структуры, которые могут содержать паракристаллиновые включения.
Тем не менее, рваные красные волокна при подтвержденных митохондриальных болезнях могут постоянно или временно отсутствовать. Дальнейшее обследование включает в себя гистохимическое окрашивание для оценки активности ферментов — сукцинатдегидрогеназы (СДГ), которая служит доказательством пролиферации митохондрий, и оксидазы цитохрома С (СОХ). СОХ кодируется как ядерной, так и митохондриальной ДНК (мтДНК), и мозаичный паттерн указывает на аномалию гетероплазменной мтДНК, тогда как общее снижение свидетельствует о мутации ядерной ДНК (Taylor et al., 2004).
Обычно разорванные красные мышечные волокна СОХ-негативны (Byrne et al., 1985), но могут быть и СОХ-позитивными (Taylor et al., 2004; DiMauro и Hirano, 2005). В некоторых случаях наблюдается избыток липидов и гликогена. Биохимический анализ активности комплекса дыхательной цепи может выявить дефекты в одном компоненте дыхательной цепи или нескольких комплексах, но такой анализ выполняется только в специализированных центрах. Дальнейшее уточнение проводится с помощью молекулярных генетических исследований зон митохондриальной и ядерной ДНК, ответственных не только за дыхательную цепь, но также за плотность митохондрий, их структуру и даже передвижение (DiMauro и Hirano, 2005).
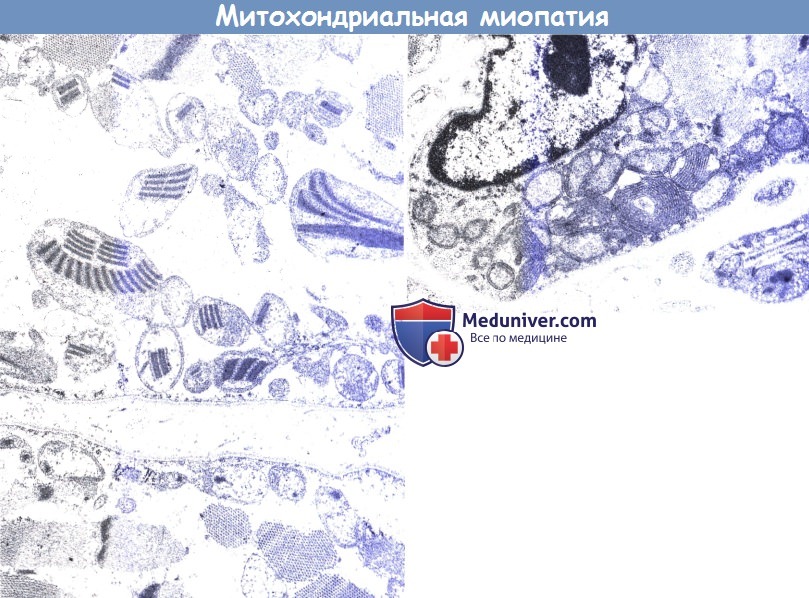
13-летний пациент с типичным анамнезом (слева). Обратите внимание на классические включения по типу «парковки» внутри митохондрии. Пятилетний пациент (справа).
Обратите внимание на пролиферацию крист внутри митохондрии. «Парковочные места» и упорядоченные паракристаллические включения в возрасте до 7-8 лет обычно не видны.
в) Клинические синдромы миопатии. Выраженная генетическая гетерогенность, отсутствие корреляции фенотип-генотип и мультисистемная природа митохондриальных расстройств свидетельствуют о том, что, хотя открыто несколько синдромов энцефалопатии с поражением мышц (например, MERRF, MELAS), существует очень мало фенотипов, характеризующихся преимущественно или исключительно миопатией. Ниже обсуждаются некоторые исключения.
г) Цитохром С оксидаза (СОХ). Одна интересная форма недостаточности СОХ проявляется тяжелым врожденным лактацидозом, слабостью и гипотонией, которые могут быть изолированными или сопровождаться поражением сердца и/или почек. Болезнь дебютирует у младенцев в возрасте от нескольких недель до трех месяцев и обычно быстро прогрессирует, вызывая дыхательную недостаточность (Zeviani et al., 1985; Darin et al., 2003). Обратимая форма недостаточности СОХ проявляется у новорожденных снижением спонтанной двигательной активности, птозом, арефлексией, повышением уровня КК и лактата сыворотки крови, но лактата в ЦСЖ не зафиксировано (Zeviani et al., 1987).
Такая же обратимость была описана при мутации гена СОХШ мтДНК, вызывающей недостаточность СОХ, которая проявляется в детстве непереносимостью физической нагрузки, генерализованной мышечной слабостью с болезненными мышечными крампи и утомляемостью (но без миоглобинурии) (Horvath et al., 2004). Nozaki et al. (1990) описали недостаточность СОХ, остро манифестирующую в возрасте семи лет, сопровождающуюся птозом, офтальмоплегией и остановкой дыхания; после терапии коэнзимом Q10 наступило выздоровление.
д) Недостаточность коэнзима Q10 (KoQ10). При манифестации недостаточности в мышцах коэнзима Q10 (убихинона) доминируют симптомы энцефалопатии, мозжечковой атаксии, также отмечается некоторая мышечная слабость (Musumeci et al., 2001). Наоборот, в некоторых случаях заболевание дебютирует симптомами миопатии: непереносимостью физической нагрузки, прогрессирующей мышечной слабостью проксимальных отделов и нагрузочной миоглобинурией. Наблюдаются разорванные мышечные волокна, накопление липидов, снижение содержания KoQ10 и снижение активности комплексов дыхательной цепи I+III и II+III (Di Giovanni et al., 2001).
Миопатия может быть изолированной (Lalani et al., 2005), но ей также могут сопутствовать симптомы энцефалопатии, например припадки или атаксия. Очень важна правильная диагностика этого расстройства, так как отмечается выраженный положительный эффект перорального приема KoQ10 (Lalani et al., 2005), хотя и не всегда (Aure et al., 2004).
ж) Другие митохондриальные миопатии. Развитие сидеробластной анемии в подростковом возрасте может быть патогномоничным признаком синдрома, названного «миопатия и сидеробластная анемия» (MLASA); заболевание начинает манифестировать непереносимостью физической нагрузки в детском возрасте. Были выявлены мутации гена псевдоуридинсинтетазы 1 (PUS1) (Bukhovskaya et al., 2004). Манифестирующая в детстве непереносимость физических нагрузок также является ранним проявлением мутации гена цитохрома b мтДНК (Andreau et al., 1999).
Прогрессирующая наружная офтальмоплегия (ПНО) наблюдается при синдроме Кернса-Сейра как одно из проявлений мультисистемного расстройства, что в 80% случаев вызвано точечной мутацией мтДНК мт 3243 (Hirano и Pavlakis, 1994). Множественные делеции мтДНК, вызванные мутациями генов ANTI, Twinkle и POLG1, наблюдаются при наследственной форме ПНО без других системных нарушений, хотя большинство случаев манифестируют во взрослом возрасте (Agostino et al., 2003).
з) Лечение. Лечение митохондриальных болезней рассмотрено в отдельной статье на сайте.
Редактор: Искандер Милевски. Дата публикации: 15.1.2019
Митохондриальная патология у детей
Представлены данные о митохондриальных болезнях в детском возрасте. Рассматриваются исторические, этиопатогенетические и генетические аспекты этой группы болезней. Описаны основные виды митохондриальной патологии, подходы к диагностике и современные предс
The article focuses on mitochondrial disorders in infancy and childhood. Authors consider historical, etiopathogenic and genetic aspects of this group of diseases. Main types of mitochondrial pathologies are described, as well as approaches to diagnostics and contemporary ideas of potential treatment methods.
Митохондриальные болезни — это группа наследственной патологии, возникающей в результате нарушений клеточной энергетики, характеризующаяся полиморфизмом клинических проявлений, выражающаяся в преимущественном поражении центральной нервной системы и мышечной системы, а также других органов и систем организма [1].
Альтернативное определение митохондриальной патологии гласит, что это обширная группа патологических состояний, обусловленных генетическими, структурными и биохимическими дефектами митохондрий, нарушением тканевого дыхания и, как следствие, недостаточностью энергетического обмена.
Как указывает A. Munnich, «митохондриальные заболевания могут вызывать любой симптом, в любой ткани, в любом возрасте, при любом типе наследования» [2].
Митохондриальные дыхательные цепи — главный конечный путь аэробного метаболизма. Поэтому митохондриальную патологию нередко называют «болезнями дыхательной цепи митохондрий» (БДЦМ); это сравнительно новый класс болезней.
Исторические аспекты митохондриальной патологии
R. Luft и соавт. (1962) обнаружили взаимосвязь между мышечной слабостью и нарушениями процессов окислительного фосфорилирования в мышечной ткани [3]. S. Nass и M. Nass (1963) открыли существование собственного генетического аппарата митохондрий (обнаружены несколько копий кольцевой хромосомы) [4, 5]. В 1960–1970 гг. появилась концепция митохондриальных болезней, то есть патологии, этиологически опосредованной митохондриальной дисфункцией. В 1980-е гг. были получены точные молекулярно-генетические доказательства митохондриальной природы ряда заболеваний (болезнь Лебера, синдром Пирсона) [6].
Этиопатогенетические аспекты митохондриальной патологии
В зависимости от наличия основного метаболического дефекта принято рассматривать четыре основных группы митохондриальных болезней: 1) нарушения обмена пирувата; 2) дефекты обмена жирных кислот; 3) нарушения цикла Кребса; 4) дефекты электронного транспорта и окислительного фосфорилирования (OXPHOS) [1, 2].
Причинами возникновения митохондриальной патологии являются мутации в генах, кодирующих белки, задействованные в процессах энергообмена в клетках (включая субъединицы комплекса пируватдегидрогеназы, ферменты цикла Кребса, компоненты цепи транспорта электронов, структурные белки цепи транспорта электронов (ЦТЭ), митохондриальные транспортеры внутренней мембраны, регуляторы митохондриального нуклеотидного пула, а также факторы, взаимодействующие с ДНК митохондрий (мтДНК) [2, 6].
Митохондриальные нарушения связаны с большим числом болезней, не являющихся первичными митохондриальными цитопатиями. Тем не менее, при этих болезнях нарушения функций митохондрий вносят значимый вклад в патогенез и клинические проявления заболеваний. Описываемые болезни могут быть метаболическими, дегенеративными, воспалительными, врожденными/приобретенными мальформациями, а также неоплазмами.
Митохондрия является органеллой, которая присутствует практически в каждой клетке, за исключением зрелых эритроцитов. Именно поэтому митохондриальные болезни могут поражать любые системы и органы человеческого организма [6]. В связи с этим правильнее называть эти состояния «митохондриальными цитопатиями» [1, 2].
Основные особенности митохондриальных цитопатий включают выраженный полиморфизм клинических симптомов, мультисистемный характер поражения, вариабельность течения, прогрессирование и неадекватное реагирование на применяемую терапию.
Конечным результатом окислительного фосфорилирования, происходящего в комплексах 1-γ, является производство энергии (АТФ). Аденозин трифосфат — основной источник энергии для клеток.
Митохондриальная ДНК тесно взаимодействует с ядерной ДНК (яДНК). В каждом из 5 дыхательных комплексов основная часть субъединиц кодируется яДНК, а не мтДНК. Комплекс I состоит из 41 субъединицы, из которых 7 кодируются мтДНК, а остальные — яДНК. Комплекс II имеет всего 4 субъединицы; большая их часть кодируется яДНК. Комплекс III представлен десятью субъединицами; кодирование мтДНК — 1, яДНК — 9. Комплекс IV имеет 13 субъединиц, из которых 3 кодируются мтДНК, а 10 — яДНК. Комплекс V включает 12 субъединиц, кодирование мтДНК — 2, яДНК — 10 [2, 6].
Нарушения клеточной энергетики приводят к полисистемным заболеваниям. В первую очередь, страдают органы и ткани, являющиеся наиболее энергозависимыми: нервная система (энцефалопатии, полинейропатии), мышечная система (миопатии), сердце (кардиомиопатии), почки, печень, эндокринная система и другие органы и системы. До недавнего времени все эти заболевания определялись под многочисленными масками других нозологических форм патологии. К настоящему времени выявлено более 200 заболеваний, причиной которых являются мутации митохондриальной ДНК [1, 2, 6].
Митохондриальные болезни могут быть обусловлены патологией как митохондриального, так и ядерного генома. Как указывают P. F. Chinnery и соавт. (2004) и S. DiMauro (2004), мутации мтДНК были выявлены в 1 случае на 8000 населения, а распространенность митохондриальных заболеваний составляет порядка 11,5 случаев на 100 тысяч населения [7, 8].
В каждой клетке находятся от нескольких сотен до нескольких тысяч органелл — митохондрий, содержащих от 2 до 10 кольцевых молекул митохондриальной ДНК, способных к репликации, транскрипции и трансляции, причем независимо от ядерной ДНК.
Генетические аспекты митохондриальной патологии
Митохондриальная генетика отличается от классической менделевской в трех важнейших аспектах: 1) материнское наследование (всю цитоплазму, вместе с находящимися в ней органеллами, потомки получают вместе с яйцеклеткой); 2) гетероплазмия — одновременное существование в клетке нормального (дикого) и мутантного типов ДНК; 3) митотическая сегрегация (оба типа мтДНК в процессе деления клетки могут распределяться случайным образом между дочерними клетками) [1, 2].
Митохондриальная ДНК накапливает мутации более чем в 10 раз быстрее ядерного генома, так как она лишена защитных гистонов и ее окружение чрезвычайно богато реактивными видами кислорода, являющимися побочным продуктом метаболических процессов, протекающих в митохондриях. Пропорция мутантной мтДНК должна превышать критический пороговый уровень, прежде чем клетки начнут проявлять биохимические аномалии митохондриальных дыхательных цепей (пороговый эффект). Процентный уровень мутантной мтДНК может варьировать у индивидов внутри семей, а также в органах и тканях. В этом заключается одно из объяснений вариабельности клинической картины у больных с митохондриальными дисфункциями. Одни и те же мутации могут вызывать различные клинические синдромы (например, мутация A3243G — энцефалопатию с инсультоподобными пароксизмами — синдром MELAS, а также хроническую прогрессирующую наружную офтальмоплегию, сахарный диабет). Мутации в различных генах могут быть причиной одного и того же синдрома. Классическим примером такой ситуации является синдром MELAS [2].
Разновидности митохондриальной патологии
Если перечислить основные митохондриальные болезни, то в их числе окажутся следующие: митохондриальная нейрогастроинтестинальная энцефалопатия (MNGIE), синдром множественных делеций митохондриальной ДНК, липидная миопатия с нормальными уровнями карнитина, недостаточность карнитин пальмитоилтрансферазы, митохондриальный сахарный диабет, болезнь Альперса–Хуттенлохера, синдром Кернса–Сейра, болезнь Лебера (LHON), синдром Вольфрама, синдром MEMSA, синдром Пирсона, синдром SANDO, синдром MIRAS, синдром MELAS, синдром MERRF, синдром SCAE, синдром NARP, синдром Барта, синдром CPEO, синдром Ли и др. [1].
Наиболее часто в детском возрасте встречаются следующие клинические синдромы митохондриальной патологии: синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз и инсультоподобные пароксизмы), синдром MERRF (миоклонус-эпилепсия с рваными красными волокнами), синдром Кернса–Сейра (характеризуется птозом, офтальмоплегией, пигментным ретинитом, атаксией, нарушением сердечного проведения), синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром Ли (подострая некротизирующая энцефаломиелопатия), болезнь Лебера (наследственная оптическая нейропатия) [1, 2].
Имеется большой пул заболеваний, причиной которых является не мутации митохондриальной ДНК, а мутации ядерной ДНК, кодирующей работу митохондрий. К ним относятся следующие виды патологии: болезнь Барта (миопатия, кардиомиопатия, транзиторные нейтро- и тромбоцитопении), митохондриальная гастроинтестинальная энцефалопатия (аутосомно-рецессивное мультисистемное заболевание): птоз, офтальмоплегия, периферическая нейропатия, гастроинтестинальная дисфункция, приводящая к кахексии, лейкоэнцефалопатия. Возраст дебюта последнего заболевания весьма вариабелен — от периода новорожденности до 43 лет.
Диагностика митохондриальной патологии
Клинические критерии диагностики митохондриальных болезней сравнительно многочисленны: 1) миопатический симптомокомплекс (непереносимость физических нагрузок, мышечная слабость, снижение мышечного тонуса); 2) судороги (миоклонические или мультифокальные); 3) мозжечковый синдром (атаксия, интенционный тремор); 4) поражение глазодвигательных нервов (птоз, наружная офтальмоплегия); 5) полинейропатия; 6) инсультоподобные пароксизмы; 7) мигренеподобные головные боли; 8) черепно-лицевая дисморфия; 9) дисметаболические проявления (рвота, эпизоды летаргии, комы); 10) дыхательные нарушения (апноэ, гипервентиляция, тахипноэ); 11) поражение сердца, печени, почек; 12) прогрессирующее течение заболевания [1, 2].
В диагностике митохондриальных болезней используются следующие клинические критерии: 1) признаки поражения соединительной ткани (гипермобильный синдром, гиперэластичность кожи, нарушения осанки и др.); 2) нейродегенеративные проявления, лейкопатии при проведении магнитно-резонансной томографии (МРТ) головного мозга; 3) повторные эпизоды нарушения сознания или необъяснимые эпизоды рвоты у новорожденных; 4) необъяснимая атаксия; 5) отставание в умственном развитии без определенных причин; 6) отягощенный семейный анамнез; 7) внезапное ухудшение состояния ребенка (судороги, рвота, расстройства дыхания, вялость, слабость, нарушения мышечного тонуса — чаще мышечная гипотония, кома, летаргия; поражение печени и почек, не поддающееся обычной терапии) [1, 2].
Лабораторные (биохимические) исследования нацелены в первую очередь на выявление у пациентов лактат-ацидоза и/или пируват-ацидоза. При этом следует помнить, что нормальные показатели молочной кислоты не исключают наличия митохондриального заболевания. Другие биохимические показатели, исследуемые при подозрении на наличие митохондриальной патологии, включают кетоновые тела в крови и моче, ацилкарнитины плазмы крови, а также содержание органических кислот и аминокислот в крови и моче [9].
M. V. Miles и соавт. (2008) предложили оценивать содержание мышечного коэнзима Q10 у детей с дефектом ферментов дыхательной цепи митохондрий [10].
Цитоморфоденситометрические исследования позволяют оценивать активность митохондрий лимфоцитов (снижение количества, увеличение объема, снижение активности).
Из инструментальных исследований (помимо методов нейровизуализации) используется биопсия скелетных мышц с проведением специфических гистохимических реакций — для выявления феномена «рваных красных волокон» (ragged red fibers — RRF) в полученном биоптате. Синдромами с «рваными красными волокнами» являются следующие: MELAS, MERRF, KSS, PEO (прогрессирующая наружная офтальмоплегия), а также синдром Пирсона. Синдромы без RRF: болезнь Leigh, NARP, LHON (наследственная оптическая нейропатия Лебера) [2].
Генетические методы исследований сводятся к определению наиболее частых мутаций и секвенированию митохондриальной ДНК.
Лечение митохондриальной патологии
Терапия митохондриальных болезней, к сожалению, не разработана. С позиций доказательной медицины считается, что эффективное лечение для этой представительной группы болезней отсутствует. Тем не менее, в различных странах мира используются фармакологические средства и биологически активные вещества, нацеленные на нормализацию метаболизма и обеспечение адекватной энергетики митохондрий.
При синдроме MELAS лечение должно быть направлено на лечение судорог, эндокринных расстройств, устранение последствий инсульта.
P. Каufmann и соавт. (2006) указывают, что поскольку уровень лактата часто коррелирует с тяжестью неврологических проявлений, целесообразно применять дихлорацетат для снижения уровня лактата [11]. В нашей стране с аналогичной целью используется диметилоксобутилфосфонилдиметилат (Димефосфон) [12].
В исследованиях японских авторов Y. Koga и соавт. (2002, 2005, 2006, 2007) с хорошим эффектом использовалось внутривенное введение L-аргинина (предшественника NO) — для стимуляции вазодилатации в остром периоде инсульта, а также пероральное его применение для снижения тяжести последующих эпизодов [13–16].
Среди средств, используемых в терапии митохондриальной патологии, фигурируют следующие: витамин В1 (тиамин) — 400 мг/сут, витамин В2 (рибофлавин) — 100 мг/сут, витамин С (аскорбиновая кислота) — до 1 г/сут, витамин Е (токоферол) — 400 МЕ/сут, никотинамид (ниацин) — до 500 мг/сут, коэнзим Q10 — от 90 до 200 мг/сут, L-карнитин — от 10 мг до 1–2 г/сут, янтарная кислота — от 25 мг до 1,5 г/cут, Димефосфон 15% — 1,0 мл на 5 кг массы тела. Применяются также цитохром С (внутривенно), Реамберин (внутривенно) и Цитофлавин (внутривенно и перорально) [17, 18].
В качестве других средств фармакотерапии выступают кортикостероиды, минералокортикоиды (при развитии надпочечниковой недостаточности), антиконвульсанты — при судорогах/эпилепсии (исключая вальпроевую кислоту и ее производные, ограничивая применение барбитуратов). В наших наблюдениях наиболее эффективной противосудорожной терапией являлось использование препаратов леветирацетам (Кеппра), топирамат (Топамакс) или их сочетаний.
Нейродиетология при митохондриальной патологии
Основным принципом диеты при митохондриальной патологии является ограничение нутриентов, оказывающих негативное влияние на механизмы обмена — до формирования метаболического блока (рацион питания одновременно обогащается другими компонентами на обычном или повышенном уровне). Такая терапевтическая стратегия получила название «обхождения блока» (going around the block). Важным исключением в этом плане является группа митохондриальных нарушений, ассоциированных с метаболизмом пирувата (недостаточность пируватдегидрогеназного комплекса с сопутствующими нарушениями со стороны углеводов/гликогена/аминокислот). При этом рекомендуются кетогенная диета и другие виды высокожировых диет [19].
Широко применяются вещества, являющиеся пищевыми кофакторами (коэнзим Q10, L-карнитин, ацетил-L-карнитин, витамин В2, аскорбиновая кислота, витамин Е, витамин В1, никотинамид, витамин В6, витамин В12, биотин, фолиевая кислота, витамин К, α-липоевая кислота, янтарная кислота, Se) [19]. Рекомендуется избегание индивидуальных алиментарных факторов, индуцирующих обострение митохондриальной болезни (голодание, потребление жиров, белков, сахарозы, крахмала, алкоголя, кофеина, мононатрия глутамата; количественные нарушения приема пищи и неадекватное потребление пищевой энергии). При необходимости осуществляется клиническое питание (энтеральное, парентеральное, гастростомия) [19].
Чрезвычайно важными являются своевременная диагностика митохондриальных болезней, поиск клинических и параклинических критериев этих заболеваний на этапе предварительном, догенетическом. Это необходимо для подбора адекватной метаболической терапии и предотвращения ухудшения состояния или инвалидизации больных с этими редкими заболеваниями.
C. S. Chi (2015) подчеркивает, что подтверждение или исключение митохондриальной патологии остается принципиальным в педиатрической практике, особенно когда клинические признаки болезни не являются специфичными, вследствие чего необходим катамнестический подход к оценке симптомов и биохимических показателей [20].
Литература
* ГОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГОУ ВПО ПМГМУ им. И. М. Сеченова МЗ РФ, Москва