мжп что это в кардиологии
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Причины дефекта межжелудочковой перегородки
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
Симптомы дефекта межжелудочковой перегородки
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Мжп что это в кардиологии
Что такое дефект межжелудочковой перегородки?
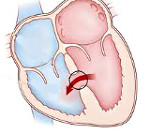
Дефект межжелудочковой перегородки (ДМЖП) – это отверстие между двумя камерами сердца – желудочками (Рис 1). ДМЖП – наиболее частый врожденный порок сердца, частота его встречаемости составляет 20% от всех врожденных пороков сердца. Сквозь это отверстие кровь из левого желудочка (камеры высокого давления) попадает в правый желудочек, где давление значительно ниже. Чем больше это отверстие, тем больше крови попадает из левого желудочка в правый желудочек, тем больше проблем возникает.
Естественное течение порока. Или к чему приведет дефект межжелудочковой перегородки?
Дефекты межжелудочковых перегородок приводят к тому, что в правый желудочек и легочную артерию поступает повышенное количество крови, что заставляет эти отделы сердца работать в режиме «свехнагрузки», приводя к развитию сердечной недостаточности. Признаками сердечной недостаточности у детей с ДМЖП могут быть: плохая прибавка в массе тела и отказ от пищи, частое дыхание (даже во сне), кашель, избыточная потливость. Перерастяжение камер сердца избыточным объемом крови приведет к нарушению работы проводящих путей и развитию различных аритмий. Избыточный объем крови, проходящий через легкие, приведет к частым бронхо-легочным заболеваниям, а в запущенных случаях – к развитию необратимых изменений со стороны сосудов легких (необратимой легочной гипертензии). Чем больше дефект, тем больше выраженность симптомов.
Лечение дефекта межжелудочковой перегородки.
Эндоваскулярное закрытие ДМЖП
Рис 2 – Внешний вид окклюдера
Рис 3 – Внешний вид спирали
В последнее два десятилетия появились устройства, позволяющие выполнить закрытие дефекта межжелудочковой перегородки не прибегая к открытому вмешательству, требующему разреза, проведения искусственного кровообращения и длительной реабилитации. Для выполнения этой манипуляции было предложено большое количество специальных устройств: окклюдеров (Рис 2) и спиралей (Рис 3). Выбор устройства (окклюдера или спирали) производится эндоваскулярным хирургом после тщательного изучения анатомии дефекта межжелудочковой перегородки. Эндоваскулярное вмешательство выполняется в условиях рентгеноперационной. В сложенном состоянии окклюдер или спираль располагаются в тоненькой трубочке – катетере. Ни разреза грудной клетки, ни использования аппарата искусственного кровообращения при этом не требуется. Через прокол сосудов на бедре окклюдер (Видео 1) или спираль (Видео 2) в «упакованном» виде, по ходу естественных сосудов вводится в полости сердца. Под контролем рентгеноскопии и эхокардиографии устанавливается таким образом, что один из его дисков (витков) располагается в левом желудочке, другой – в правом желудочке. Дефект оказывается полностью закрыт заплаткой, которая исключает сброс крови из левого желудочка в правый. Если окклюдер или спираль установлены правильно, катетер отсоединяется и извлекается наружу, если произошло смещение, окклюдер (или спираль) может быть снова втянут в доставляющий катетер и процесс установки повторится.
Для закрытия мышечных дефектов чаще используют окклюдеры (Видео 3, 4), а для перимембранозных – спирали (Видео 5, 6).
На сегодняшний день более чем у 60% пациентов дефект межжелудочковой перегородки может быть устранен при помощи эндоваскулярной операции. В то же время имеются противопоказания. Это близость расположения дефекта к клапанам сердца, наличие у пациента других внутрисердечных аномалий, требующих хирургической коррекции, вес пациента меньше 5 кг, наличие активного инфекционного процесса и различные нарушения свертывания крови.
У детей весом меньше 5 кг невозможно эндоваскулярное вмешательство, так как катетеры со сложенным внутри окклюдером или спиралью слишком большие для маленьких сосудов ребенка. В последние годы активно развивается гибридный метод лечения, который позволяет лечить ДМЖП у детей меньше 5 кг с выраженной симптоматикой, без использования искусственного кровообращения. Гибридный метод предусматривает совместную одновременную работу кардиохирургов и эндоваскулярных хирургов. Проводится гибридная операция в кардиохирургической операционной. Кардиохирурги открывают грудную клетку и делают небольшой прокол на сердце, через который под контролем УЗИ в сердце вводятся катетер со сложенным устройством внутри. Сам процесс закрытия аналогичен таковому, как при эндоваскулярном закрытием. При гибридном методе, в отличие от стандартной кардиохирургической операции, сердце не разрезают и не останавливают (катетеры вводятся через маленький прокол), а искусственное кровообращение не используют.
Реабилитация после процедуры
Как правило, пациентов выписывают через два дня после процедуры. На месте введения катетера в сосуд еще некоторое время должна оставаться стерильная повязка. В течение 6 месяцев после операции необходимо принимать аспирин для профилактики тромбообразования и в случае простудных заболеваний проводить антибиотикопрофилактику инфекционного эндокардита. В течение одного месяца после процедуры необходимо будет ограничить физические нагрузки. Уже через 6 месяцев после операции окклюдер (или спираль) полностью покрывается собственными клеточками сердца – эндотелизируется. До этого времени пациентам стоит воздержаться от плановой вакцинации и планирования беременности. Спустя 6 месяцев наш пациент может вести привычный для него образ жизни – теперь он абсолютно здоров!
У нас наибольший в Украине опыт по эндоваскулярному закрытию дефектов межжелудочковой перегородки – более 20 операций. Мы имеем доступ к окклюдерам и спиралям для закрытия дефектов любых размеров, как мышечных, так и перимембранозных. Для того чтобы попасть к нам на консультацию или госпитализироваться позвоните по одному из телефонов или запишитесь на прием онлайн.