микотический эзофагит что это
Что такое эзофагит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверин А. А., эндоскописта со стажем в 14 лет.
Определение болезни. Причины заболевания
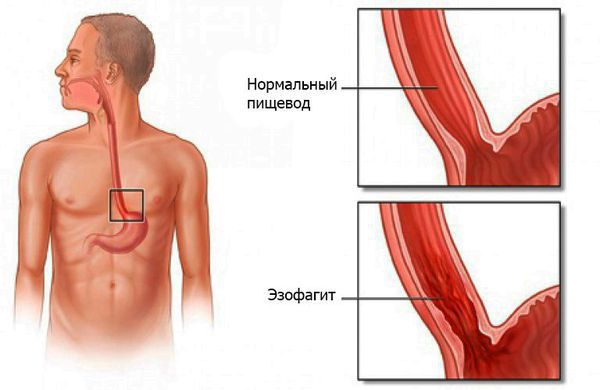
Эзофагит — воспаление слизистой оболочки пищевода, возникающее под действием инфекций, химических веществ, физических факторов и генетической предрасположенности.
Выделяют три формы эзофагита:
Эзофагит развивается под влиянием внешних и внутренних причин.
Внешние причины воспаления слизистой оболочки пищевода:
1. Инфекционные — воздействие патогенных микробов, например грибов рода Candida и герпесвирусов. Инфекционная форма эзофагита преобладает у людей с иммунодефицитом, но необязательно вызванного ВИЧ-инфекцией. Также высокий риск развития заболевания у пациентов, длительно принимающих стероиды при бронхиальной астме и хронической обструктивной болезни лёгких.
2. Химические — влияние агрессивных веществ (кислот или щелочей) и некоторых лекарственных средств:
3. Физические — факторы окружающей среды, такие как температура, излучение, механическое воздействие:
Внутренние причины эзофагита:
Вышеперечисленные факторы приводят к воспалению слизистой оболочки пищевода. В зависимости от интенсивности и продолжительности процесса оно протекает или остро, приводя к развитию острого эзофагита, или длительно, вызывая хроническую форму болезни.
Симптомы эзофагита
Симптомы заболевания различны в зависимости от вида эзофагита. Самый распространённый тип данного заболевания — рефлюкс-эзофагит.
К основным симптомам рефлюкс-эзофагита относятся:
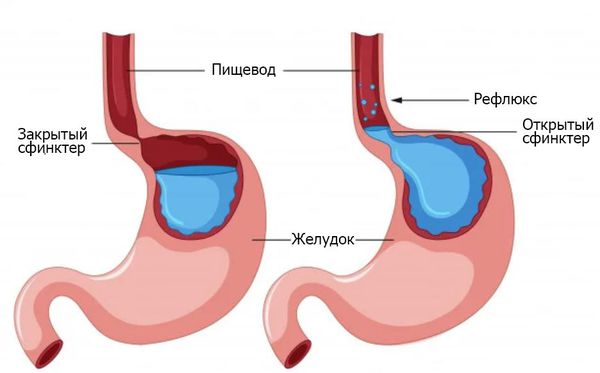
Рефлюск-эзофагит — один из вариантов течения гастроэзофагеальной рефлюксной болезни (ГЭРБ) с воспалением пищевода. В основе ГЭРБ лежит нарушение моторной функции нижнего пищеводного сфинктера и постоянные забросы кислого содержимого желудка в пищевод. Симптомы заболевания делятся на пищеводные и внепищеводные.
Пищеводные симптомы ГЭРБ:
Внепищеводные проявления ГЭРБ:
Основные симптомы инфекционного эзофагита:
Вышеописанные симптомы часто сочетаются с лихорадкой, сепсисом, анорексией и потерей веса. Иногда пациентов беспокоит кашель.
При развитии осложнений добавляются новые симптомы:
Симптомы хронического эзофагита
Все описанные симптомы характерны как для острого, так и для хронического эзофагита. Разница между ними в выраженности и продолжительности болезни:
В дальнейшем при хроническом эзофагите периоды обострения чередуются с ремиссией.
Патогенез эзофагита
Различные формы эзофагита отличаются причинами, вызвавшими заболевание, и механизмами развития воспаления в слизистой оболочке пищевода.
Рефлюкс-эзофагит
Рефлюск-эзофагит — один из вариантов течения гастроэзофагеальной рефлюксной болезни (ГЭРБ) с развитием воспаления пищевода. Патогенез рефлюкс-эзофагита:
Инфекционный эзофагит
Эозинофильный эзофагит
Эозинофильный эзофагит развивается следующим образом:
Классификация и стадии развития эзофагита
В Международной классификации болезней (МКБ-10) эзофагит кодируется как К20.
По этиологии:
По характеру поражения:
По распространённости:
По локализации:
По течению:
По периодам болезни:
По клиническим проявлениям:
По осложнениям:
В клинической практике наиболее распространены две эндоскопические классификации для хронической и острой формы эзофагита.
Классификация H. Basset различает четыре степени острого эзофагита [3] :
В зависимости от выраженности поражения стенки пищевода хронический эзофагит делят на четыре степени (классификация Савари — Миллера) [9] :
При рефлюкс-эзофагите (ГЭРБ) используется Лос-Анджелесская классификация [4] :
Стадии эзофагита:
Стадии повторяются и приводят к развитию осложнений.
Осложнения эзофагита
При длительном течении хронического эзофагита (чаще при рефлюкс-эзофагите) развиваются следующие осложнения:
Одним из наиболее опасных осложнений эзофагита является развитие рака пищевода — аденокарциномы.
Диагностика эзофагита
Общий осмотр пациента не даёт результатов, так как эзофагит не имеет внешних проявлений. Лабораторные методы также неинформативны, они помогут только выявить осложнение заболевания — кровотечения из верхних отделов желудочно-кишечного тракта. При подозрении на иммуносупрессию пациенты сдают развёрнутый клинический анализ крови и тесты на ВИЧ.
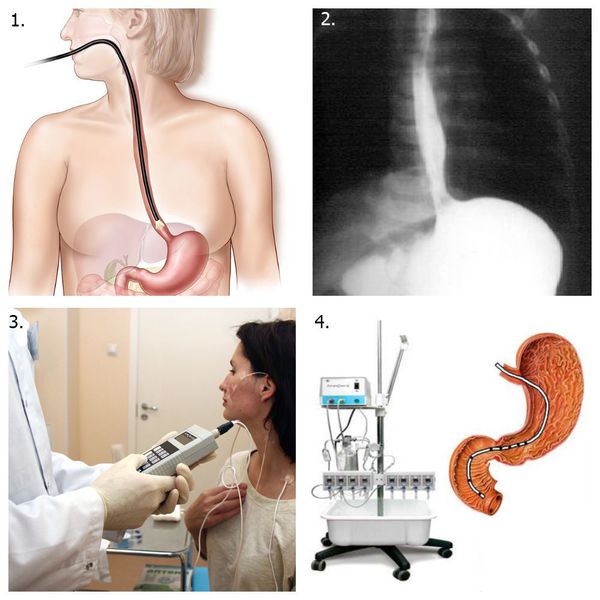
Для диагностики эзофагита применяют инструментальные методы:
Вспомогательные методы:
Ведущими методами диагностики является ЭГДС и рентгенологическое исследование пищевода. При этом рентгенографическое исследование пищевода с барием и эндоскопия верхних отделов ЖКТ дополняют друг друга, а не конкурируют.
Лечение эзофагита
Лечение эзофагита зависит от типа и причины заболевания. Чаще применяется медикаментозная терапия.
Консервативное лечение
Лечение рефлюкс-эзофагита:
При лекарственном эзофагите — отмена препарата или замена на лекарства без побочных эффектов. Таблетки следует запивать не менее чем 100-150 мл воды и оставаться в вертикальном положении 30 минут после их приёма.
При лечении эозинофильного эзофагита и подозрении на пищевую аллергию последовательно исключают различные продукты питания — потенциальные аллергены.
Лечение инфекционного эзофагита направлено на подавление возбудителя и зависит от его природы (грибы, бактерии, вирусы):
Лечение других типов эзофагита зависит от основного заболевания, которое привело к патологии. Распространённые варианты лечения:
Диета
При эзофагите нежелательно употреблять жирную и острую пищу, кофе, газировку, шоколад, горячие напитки и блюда с температурой более 40 °С.
Хирургическое лечение
Операции при эзофагите, как правило, не проводятся. Их выполняют, только если не помогло медикаментозное лечение и развились осложнения.
К таким операциям относятся:
При метастатическом раке пищевода с эзофагитом применяется лучевая терапия в сочетании с паллиативным стентированием.
Прогноз. Профилактика
При своевременной диагностике и правильном лечении прогноз положительный, но на него влияет тяжесть основного заболевания и развитие осложнений.
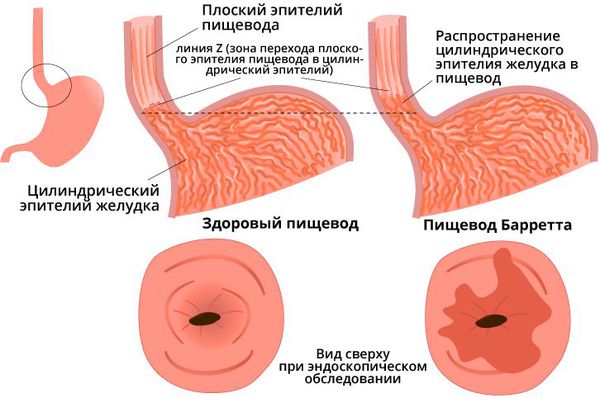
При появлении осложнений прогноз становится неблагоприятным. Пищевод Барретта является предраковым состоянием и приводит к аденокарциноме пищевода. При развитии стенозов и стриктур пищевода поступление пищи в желудок нарушается, что вызывает истощение и потерю веса с исходом в гипотрофию.
При тяжёлых формах эзофагита могут развиваться такие осложнения, как кровотечение и перфорация. Прогноз при этом крайне неблагоприятный, возможен летальный исход.
Профилактика эзофагита сводится к исключению или ограничению факторов, повреждающих слизистую оболочку пищевода.
Изменения образа жизни и питания — важные составляющие лечения и профилактики эзофагита [12] :
Эзофагит
Среди всех болезней пищевода особенно выделяется одно, возникающее чаще всего. Это эзофагит – воспалительное заболевание пищевода. Частые симптомы: жжение в области груди, дискомфорт при глотании, изжога, отрыжка. Эзофагит опасен тем, что при отсутствии должного лечения он значительно снижает качество жизни и в ряде случаев может перейти в осложненную форму. В особо запущенных случаях возможен стеноз пищевода или перфорация стенки, а также развитие рака пищевода – это состояния, угрожающие жизни. Во избежание осложнений требуется своевременная диагностика и лечение.
Для постановки диагноза потребуется сделать несколько исследований: эндоскопию и рентгенографию, а также биопсию слизистой пищевода при наличии показаний. Лечение зависит от этиологии и включает в себя как медикаментозную терапию, так и рекомендации по изменению образа жизни. Если патологические изменения стенок пищевода необратимы, то потребуется оперативное вмешательство.
Причины
Причин эзофагита может быть множество: от механических травм и химического повреждения слизистой оболочки до инфекционных заболеваний. Существуют формы заболевания, ассоциированные с гастритом. В таком случае развитие эзофагита нередко провоцирует заброс кислоты из желудка. Такая патология носит особое название гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
К наиболее частым причинам относят:
Чаще всего наиболее тяжелые последствия наблюдаются после ожогов (термических и химических). Инфекционный эзофагит, как правило, развивается на фоне общего снижения иммунитета. У здоровых людей вирусные и бактериальные агенты не задерживаются в области пищевода.
Инфекционный эзофагит может быть осложнением гриппа, дифтерии и других вирусных и бактериальных заболеваний. Отдельно выделяют кандидозный эзофагит, возникающий при поражении слизистой грибковой флорой.
Хронический эзофагит
Отдельным списком выделяют причины хронического эзофагита:
Для каждой формы предусмотрено свое лечение, поэтому на стадии диагностических мероприятий важно выяснить разновидность и причины заболевания.
Симптомы
Проявления различаются для острой и хронической формы. Острый эзофагит характеризуется нарастающими симптомами. Выраженность симптомов зависит от степени поражения слизистой. Катаральная форма часто протекает бессимптомно.
Основные симптомы эзофагита:
Симптомы острого эзофагита проходят спустя 7-10 дней, после чего может наступить период покоя. При сохранении факторов риска и отсутствии лечения через какое-то время симптомы возобновляются, болезнь прогрессирует.
Без лечения развиваются осложнения эзофагита:
При длительном течении хронической формы возможно перерождение клеток слизистой с развитием предракового состояния и рака пищевода.
Диагностика
Диагностика проводится с целью дифференцировать эзофагит от заболеваний со схожей симптоматикой, а также выявить причину развития болезни. Легче всего осуществляется постановка диагноза для острого заболевания: пациенты жалуются на специфическую боль. Жжение за грудиной (изжога) – это типичный симптом для воспаления пищевода, который заставляет пациента обратиться к врачу-гастроэнтерологу. Врач проводит опрос, выясняя возможные причины развития болезни, осмотр, а затем назначает дополнительные обследования.
В рамках диагностики эзофагита применяются такие методы:
По результатам обследования лечащий врач выбирает тактику лечения.
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
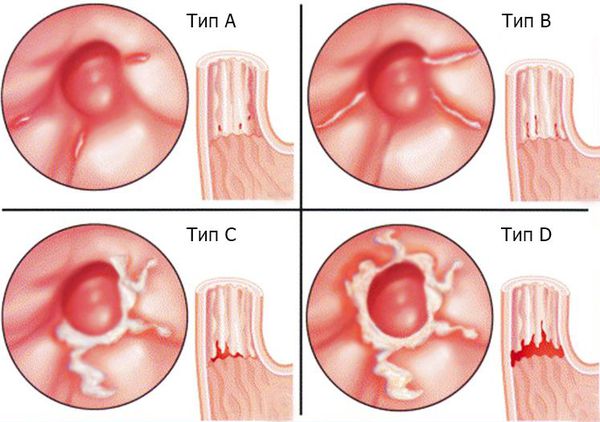
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
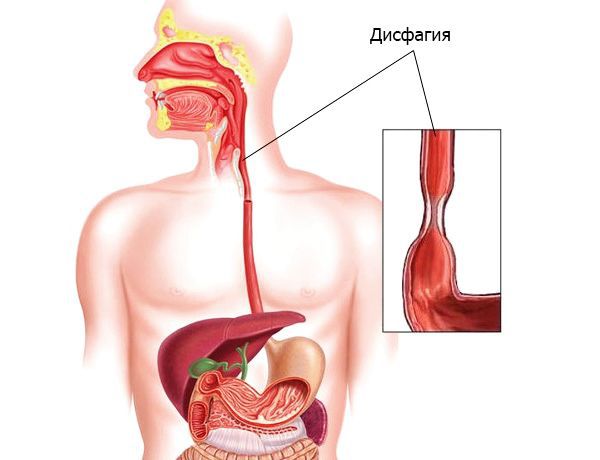
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
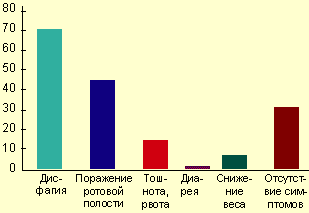 |
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
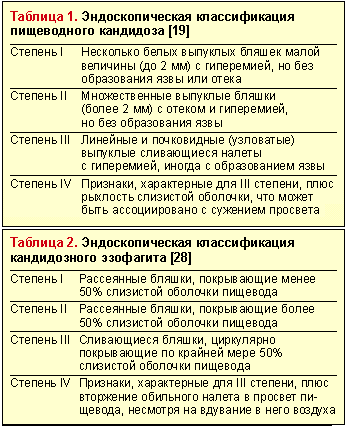
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию